このページで
急性肝障害(ALI)および自己免疫性肝疾患(AIH)は、適切に管理されないと肝不全に至る可能性のある深刻な疾患です。ALIは、通常毒素、ウイルス感染、または虚血などの要因によって引き起こされ、肝細胞の壊死と炎症を引き起こします。AIHを含む自己免疫性肝疾患は、免疫系が誤って肝臓を攻撃することで発症し、慢性的な炎症を引き起こし、肝硬変へと進行する可能性があります。
これらの状態を研究し、潜在的な治療法を評価するために、当社はAPAP誘発およびコンカナバリンA(Con A)誘発の急性肝損傷モデルを含むさまざまな動物モデルを開発しました。これらのモデルは、疾患メカニズムの研究と、肝損傷および炎症を軽減するための新しい治療戦略を評価するために重要です。
APAPは経口投与後最初の2時間以内に腸内で吸収され、グルクロン酸抱合および硫酸化を通じて肝臓で代謝され、尿中に排泄されます。少量(10-15%)は、肝細胞でシトクロムP450アイソフォームによってアルキル化された非常に有毒な代謝物N-acetyl-p-benzoquinoneimine(NAPQI)に代謝されます。抗酸化物質グルタチオン(GSH)は、NAPQIをより有害でない還元型に変換し、その後胆汁を通じて排泄されます。グルタチオンが枯渇すると、増加したNAPQIがミトコンドリアタンパク質に結合し、肝細胞壊死を引き起こします。
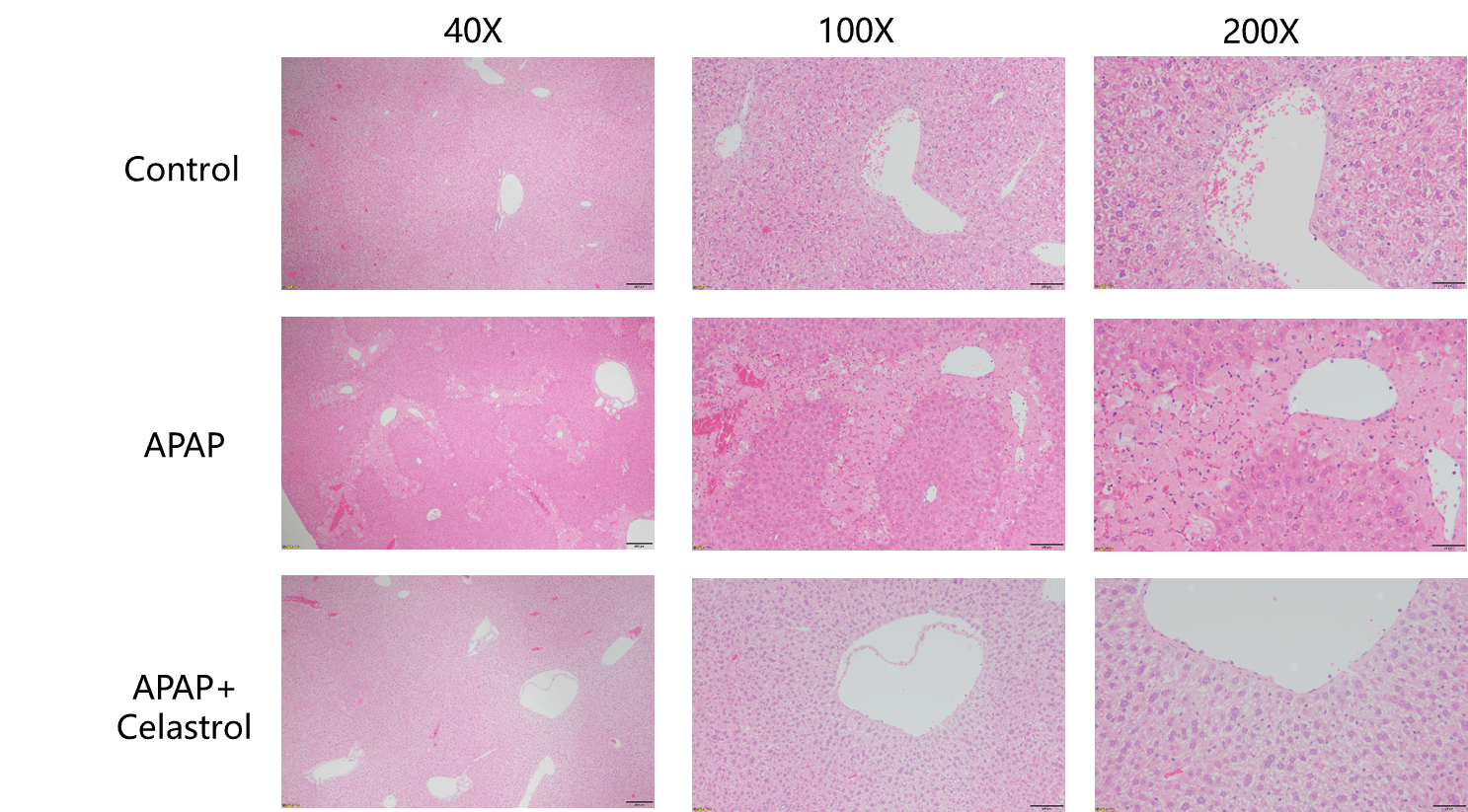
肝障害に対するCelastrolの保護効果 モデル動物の肝臓では、肝小葉の辺縁帯における細胞の凝固壊死および挫傷がさまざまな程度に見られ、セラストロール投与群では病理に著しい改善が見られました。
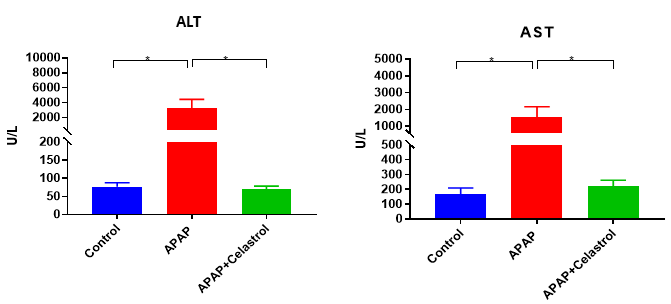
Celastrol治療は、APAPによって誘発されたALTおよびAST酵素活性の増加を軽減しました。値は平均±SEMで表されます。N = 8匹のマウス(群ごと)。*p<0.05。
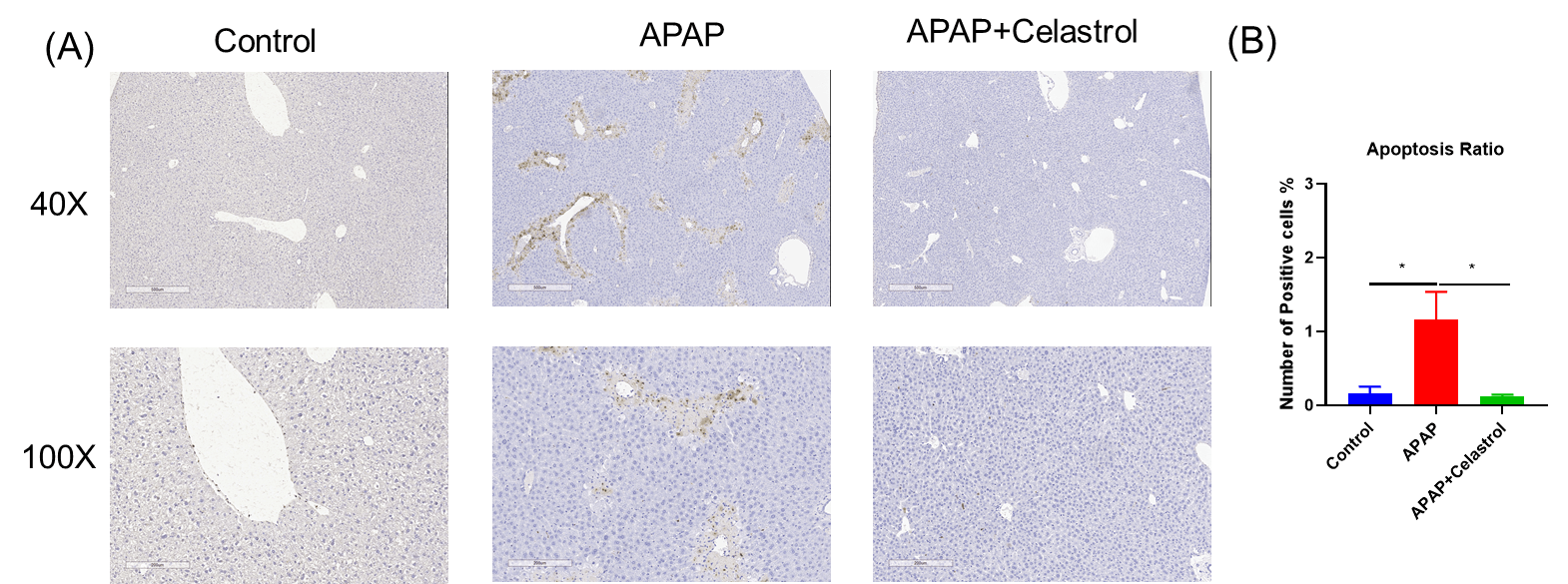
APAP誘発肝損傷におけるCelastrolによるアポトーシスの減少 A、チュネル染色による肝細胞のアポトーシス。B、チュネル陽性染色の統計データ。値は平均±SEMで表されます。N = 8匹のマウス(群ごと)。*p<0.05。
ConA誘発マウス肝炎モデルは、T細胞とマクロファージの活性化を介して肝障害を引き起こし、その病態と病理学的変化はヒトの自己免疫性肝炎の病態と部分的に類似していることから、自己免疫性肝炎などの疾患の病態、病理学的変化、臨床治療の研究に広く用いられています。肝細胞のアポトーシス、壊死、白血球浸潤は、免疫性肝炎の顕著な特徴として認められます。このモデルでは、活性化T細胞とマクロファージが肝組織間葉系に浸潤し、TNF-α、IFN-γ、IL-1β、IL-2などの炎症誘発因子の分泌を誘導します。
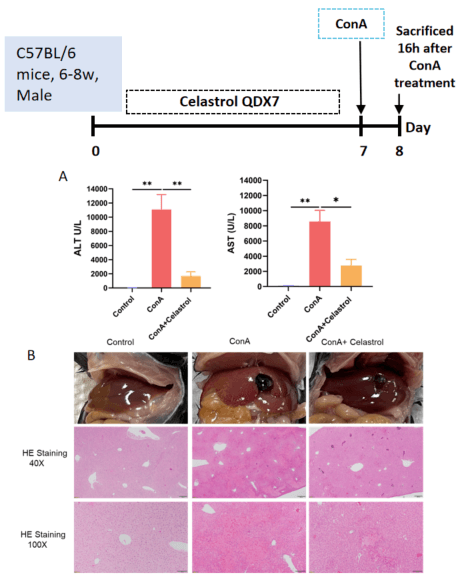
A、Celastrolは、ConAによって誘発されたALTおよびAST酵素活性の増加を軽減することが示されました。B、ConA誘発NASHマウスモデルにおけるCelastrolの保護効果に関するH&E染色の分析。値は平均±SEMで表されます。N = 8匹のマウス(群ごと)。*p<0.05、**p<0.01。
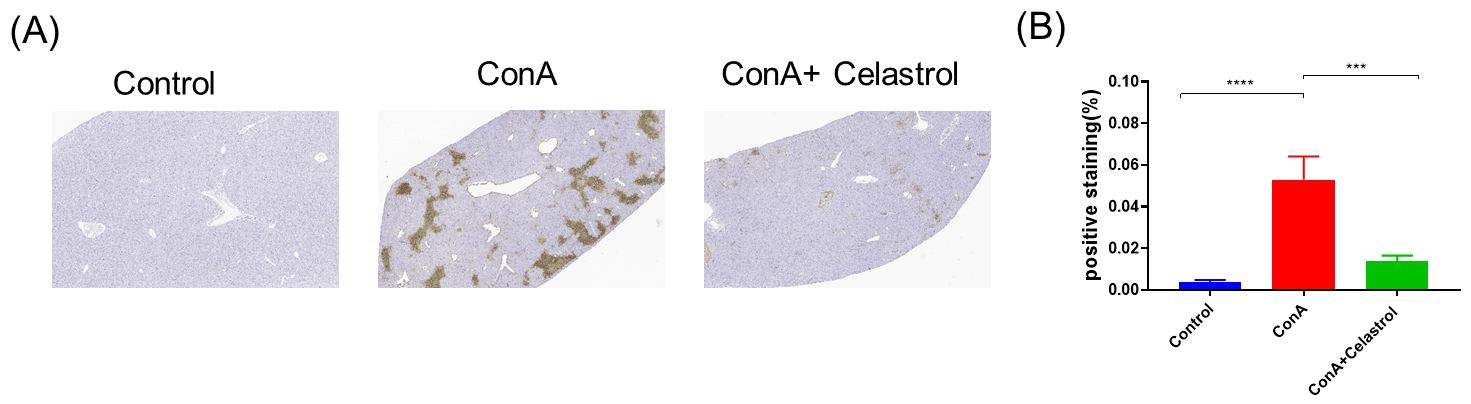
ConA誘発急性肝損傷マウスモデルにおけるCelastrolの保護効果の病理学的解析 A、チュネル染色による肝細胞のアポトーシス。B、チュネル陽性染色の統計データ。値は平均±SEMで表されます。N = 8匹のマウス(群ごと)。***p<0.001。
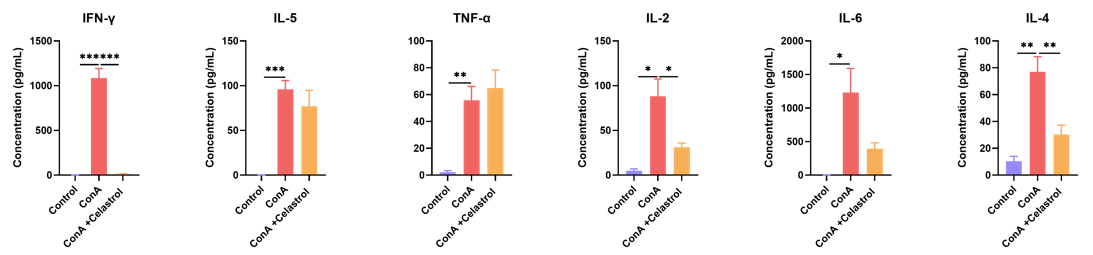
Celastrolは、Con Aによって誘発されたサイトカインレベルの増加を軽減しました N = 8匹のマウス(群ごと)。*p<0.05。