このページで
Biocytogen の技術専門家チームと営業担当は、研究者の動物モデルに関するニーズを実現するために努めています。当社のカスタムモデルで利用されている遺伝子標的化戦略には以下のものが含まれます。
コンベンショナルノックアウト(KO)マウスモデルでは、標的遺伝子のエクソンを全体的に削除(EGE™法)するか、ポジティブ選択マーカー(多くの場合、ネオマイシン)で置換(ESC/HR法)することで、遺伝子を不活性化します。コンベンショナルノックアウト(KO)マウスでは、対象遺伝子はあらゆる組織で破壊されます。
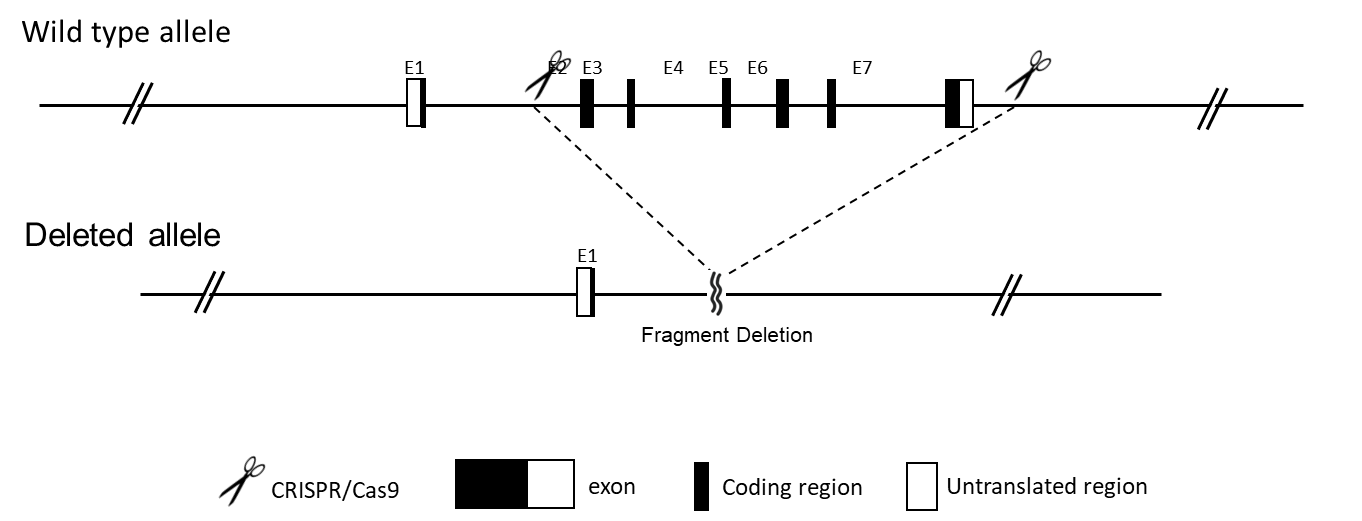
コンベンショナルノックインマウスモデルは、マウスゲノムの特定の遺伝子座に変異体または外来性DNA配列を導入します。これらのモデルは、変異を導入することで遺伝性疾患を模倣したり、遺伝子に様々なタンパク質(例:EGFP、mRFP、mCherry、YFP、LacZ、Flag)をタグ付けすることで遺伝子発現をモニタリングしたりできます。
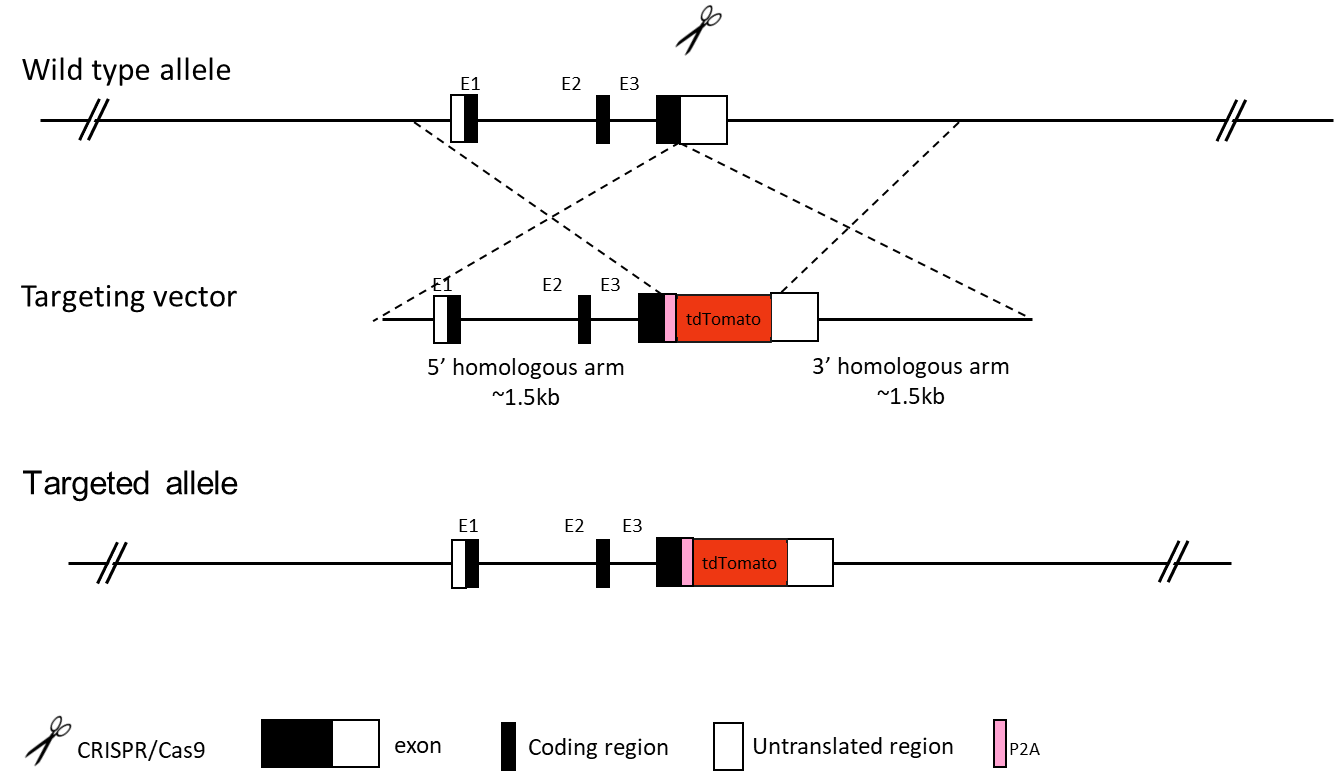
条件的ノックアウト(cKO)モデルは、Cre-LoxP/Flp-Frt 組換えシステムを介して作製されます。ノックアウト対象となる標的フラグメントは、LoxP(または Frt)エレメントによって挟まれた状態にします。次に、フロクスドマウス(floxed mice)を組織特異的な Cre マウスまたは Flp マウスと交配させることで、子孫のゲノムから LoxP 部位間の配列が組織特異的なパターンで除去されます。一般的な設計では、Cre マウスは標的組織においてのみ組換え反応を誘導します。LoxP フラグメントは通常、ATG を含むエクソンの下流にあるイントロンに挿入され、挟まれたエクソンの除去によりフレームシフトが生じ、タンパク質発現が阻害されます。

条件的ノックイン(cKI)マウスモデルでは、フロクスドアリルを持つマウスと組織特異的または誘導性の Cre マウスもしくは CreERT2 マウスを交配させることで、点突然変異、レポーター遺伝子、機能的カセットといった外因性遺伝子エレメントの組織特異的な活性化を実現します。これにより、Cre リコンビナーゼが存在する部位に限って遺伝子の活性化が起こるように保証されます。これらのモデルは通常、FLEx(Flip-Excision/dual-lox)システムまたはミニジーンベースの設計を用いて作製され、操作された突然変異やレポーター遺伝子が空間的および / または時間的に制御された様式で発現することを可能にします。この Cre-lox 駆動型の cKI 戦略は、遺伝子制御の研究、系統追跡(lineage tracing)の実施、および細胞型特異的な生物学的機能の解明に広く活用されています。
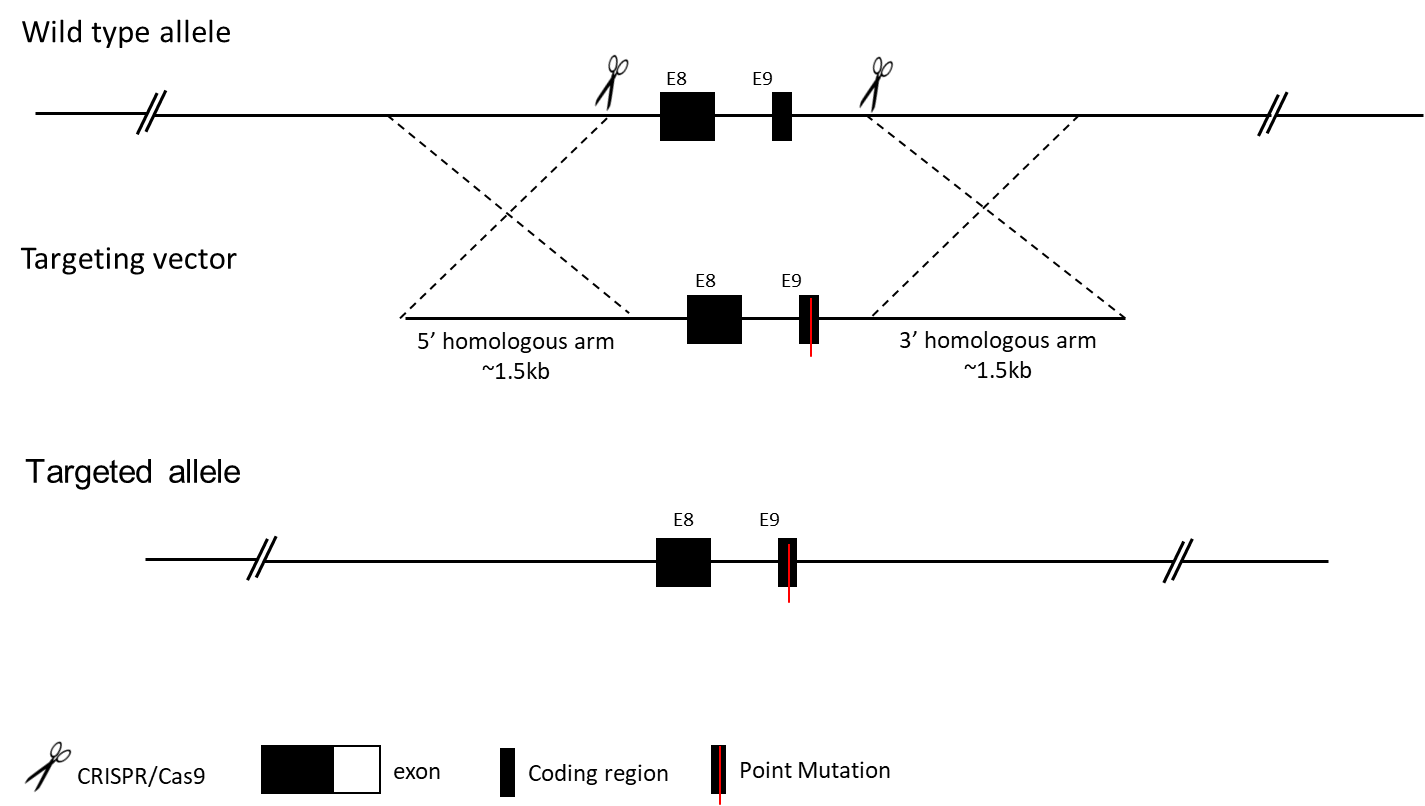
コンベンショナルポイントミューテーションマウスモデルは、マウスのゲノムの1つ以上のヌクレオチドが変異ヌクレオチドに置換されるノックインマウス系です。これにより、特定のタンパク質配列内で同じフレームのアミノ酸の変化が起こるか、フレームシフト突変が起こることがあります。ポイントミューテーションノックインマウスモデルは、タンパク質内の特定のヌクレオチドまたはアミノ酸の役割を研究するために広く使用されており、ヒトの遺伝性疾患の研究に直接応用できます。
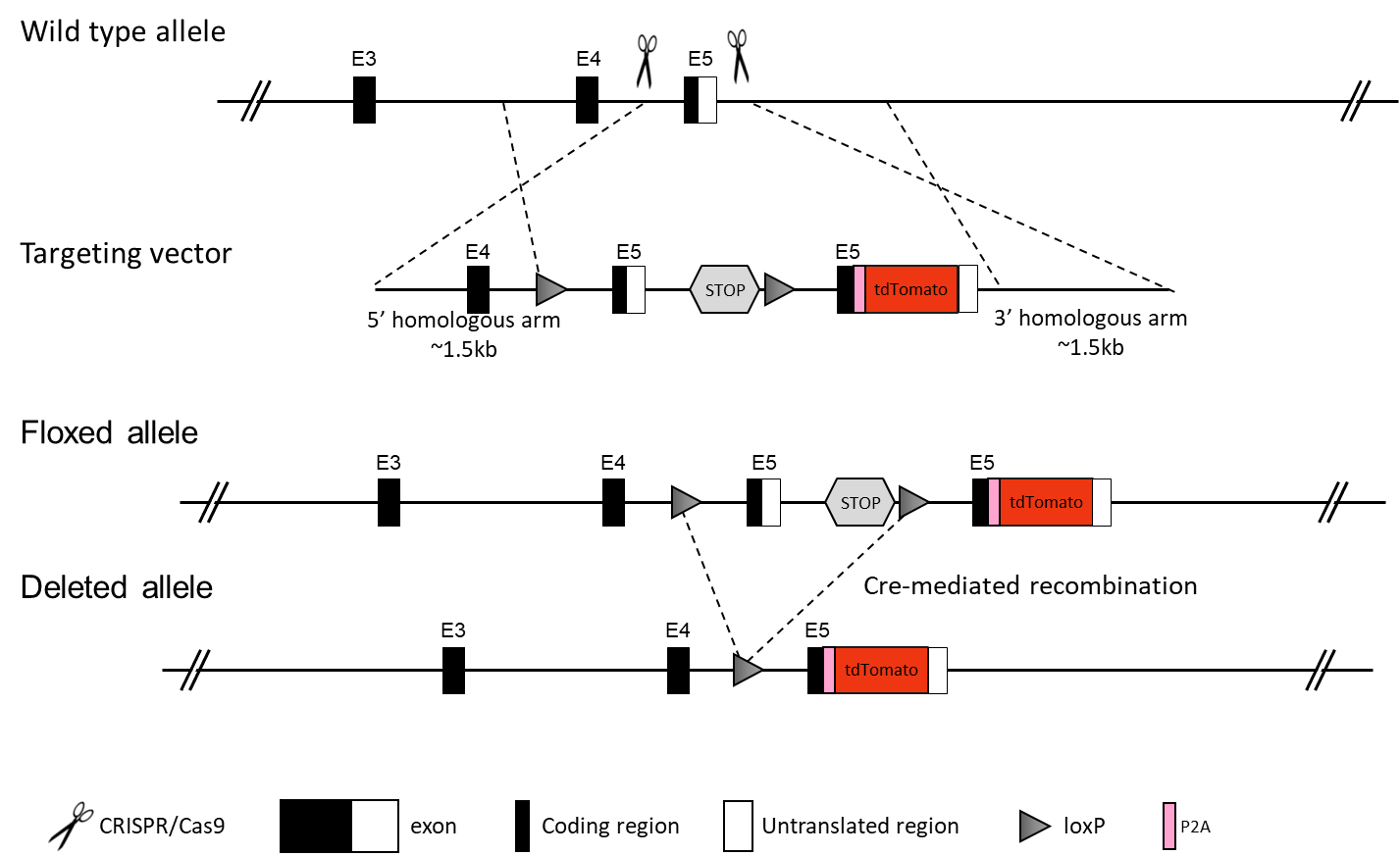
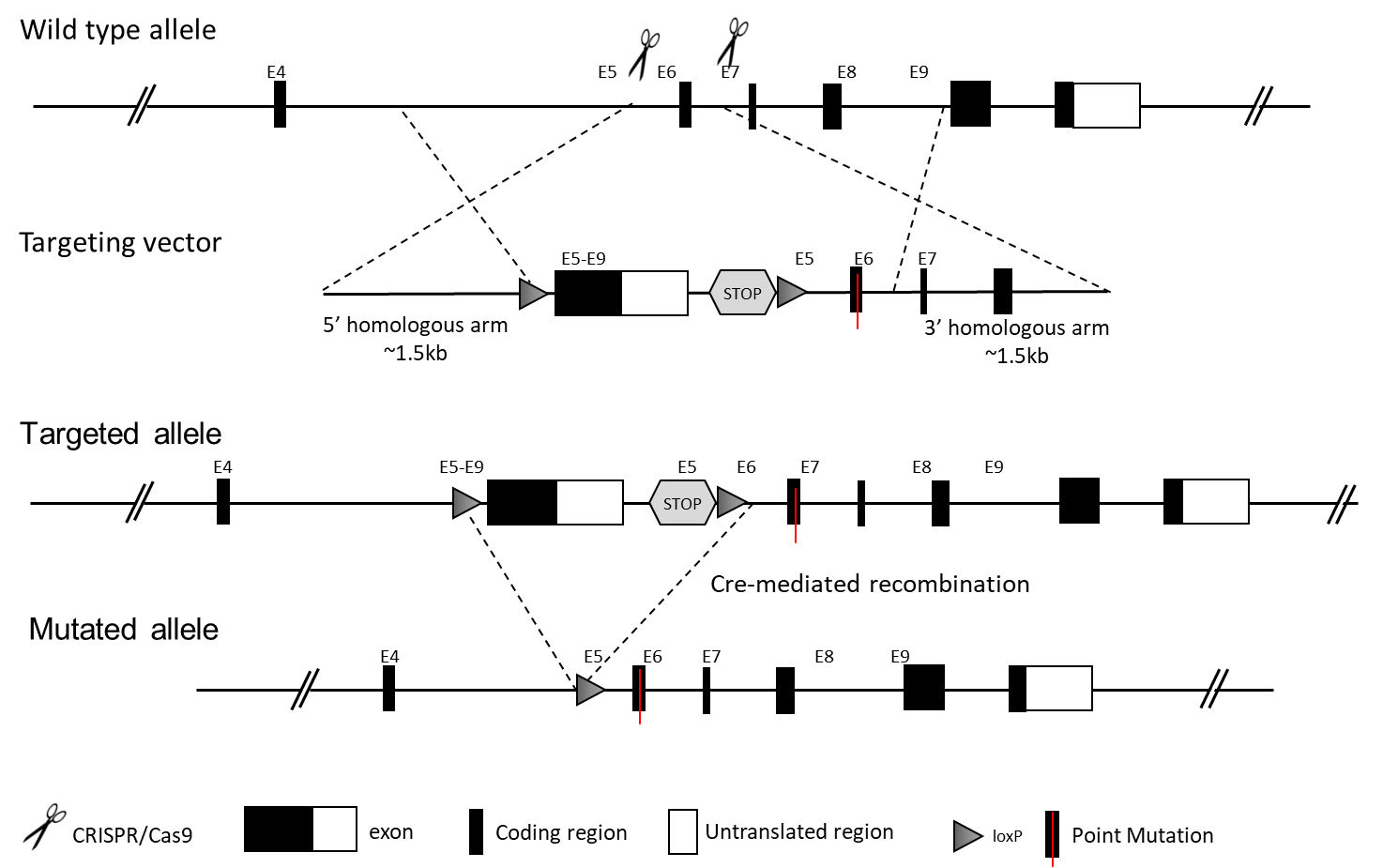
コンディショナルポイントミューテーションマウスモデルは、特定の条件が満たされた際にポイントミューテーションを導入します。以下の遺伝子ターゲティング戦略では、Creリコンビナーゼが存在する場合、Cre活性を介して組織特異的にポイントミューテーションが導入されます。以下に2つの主要な設計戦略を示します。
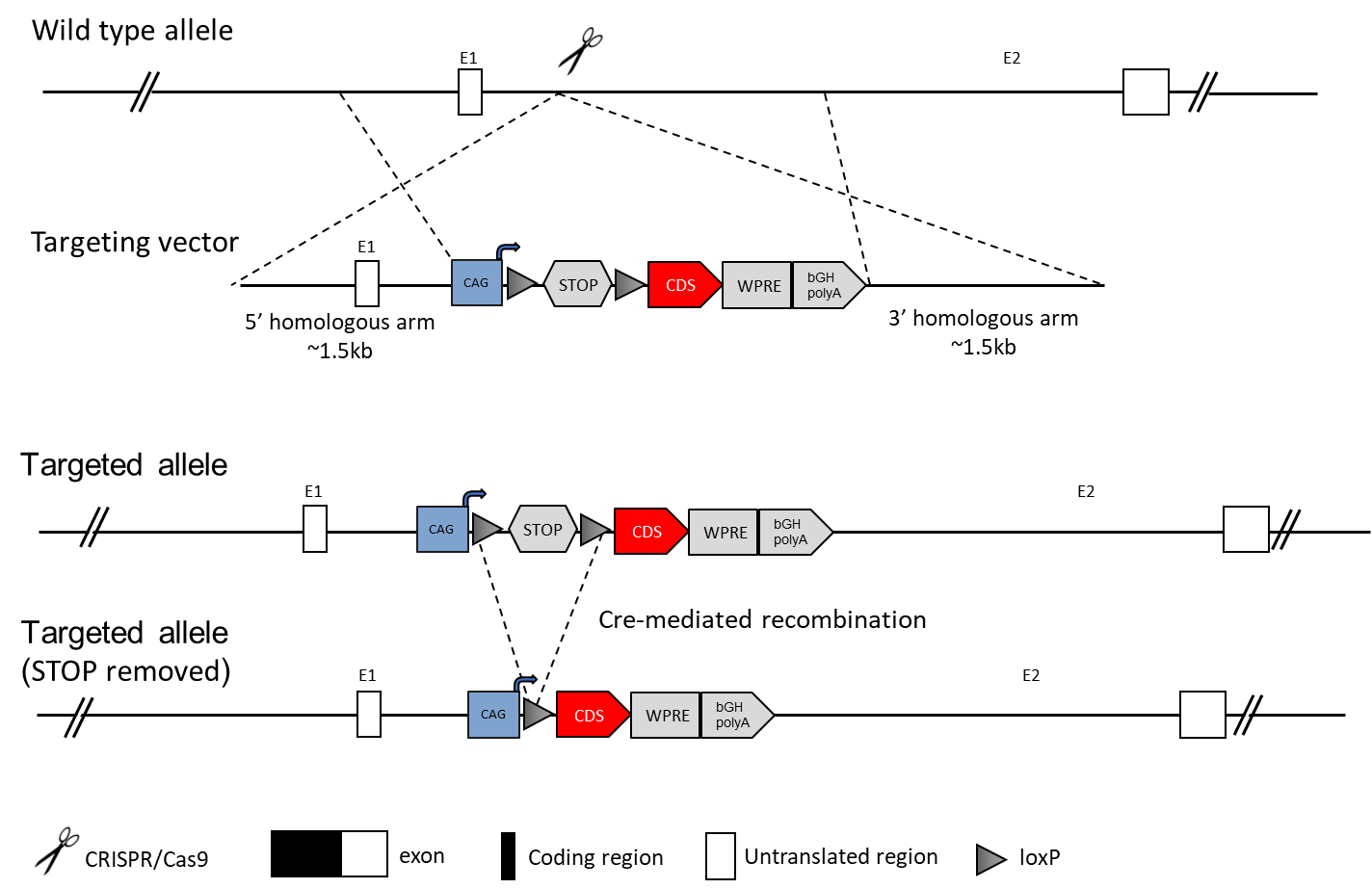
従来のトランスジェニックマウスモデルは、プラスミドの前核注入によって作製され、多くの異なるファウンダー遺伝子が得られます。異なるファウンダー遺伝子からの実験結果は、組み込みコピー数と遺伝子座の違いにより異なり、再現性がない場合があります。現在、多くの研究者は、遺伝子編集マウスモデルの構築に部位特異的インテグレーション戦略を用いています。Rosa26は、ほぼすべての組織で発現する非必須の核RNAをコードするため、最も一般的に使用される「セーフハーバー」遺伝子座です。外来遺伝子の条件付き発現は、Rosa26遺伝子座の外来遺伝子配列の上流にLoxP-3XSTOP-LoxP配列を挿入し、このモデルをCreデリーターと交配することで得られます。その他のセーフハーバー遺伝子座の例としては、H11やTIGREなどが挙げられます。
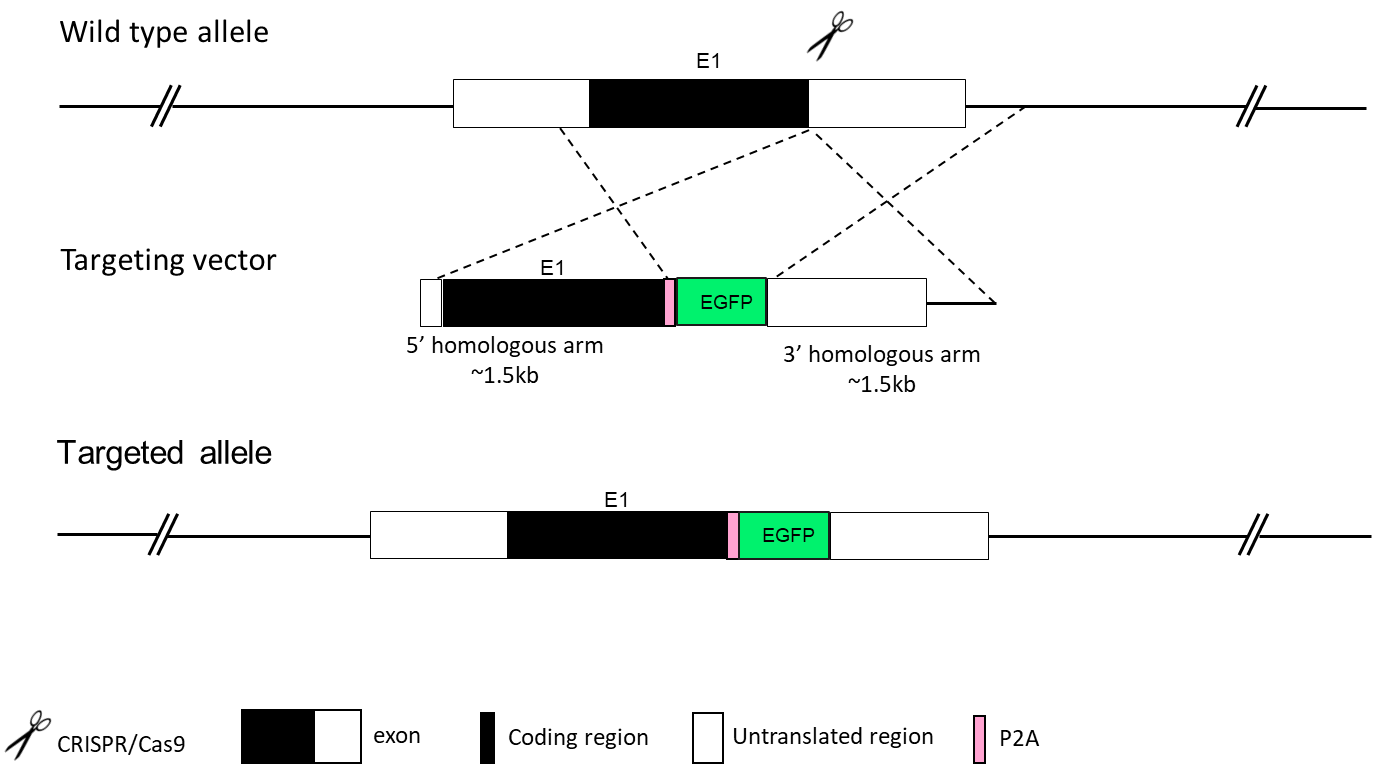
EGFP、YFP、LacZ、Flag、mCherryなどの配列でタグ付けされた遺伝子は、遺伝子発現のモニタリングに有用です。レポーター遺伝子マウスモデルは、細胞発生研究のための系統樹構築に用いられます。内因性遺伝子をレポーター遺伝子に置換することで、同一のマウスモデルにおいて遺伝子ノックアウトとノックインを同時に達成することができます。
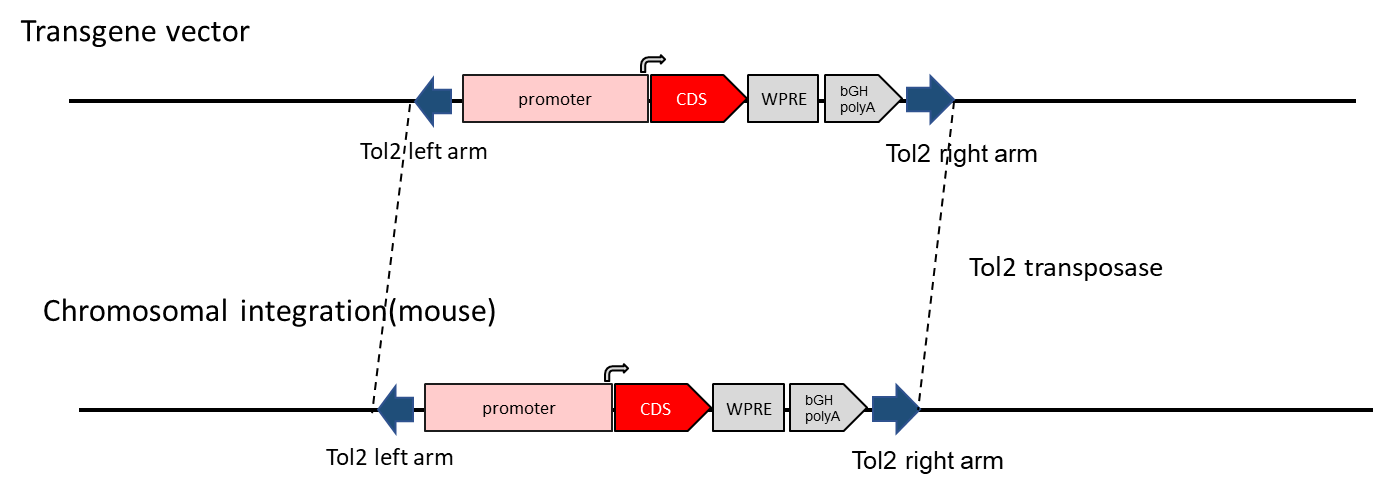
TTol2マウスモデルは、Tol2トランスポザーゼ活性を利用したトランスジェニックマウスの作製を可能にします。Tol2トランスポゾンシステムは、遺伝子組み込み率を高めるだけでなく、ATリッチな領域に外来遺伝子を組み込む傾向も持っています。
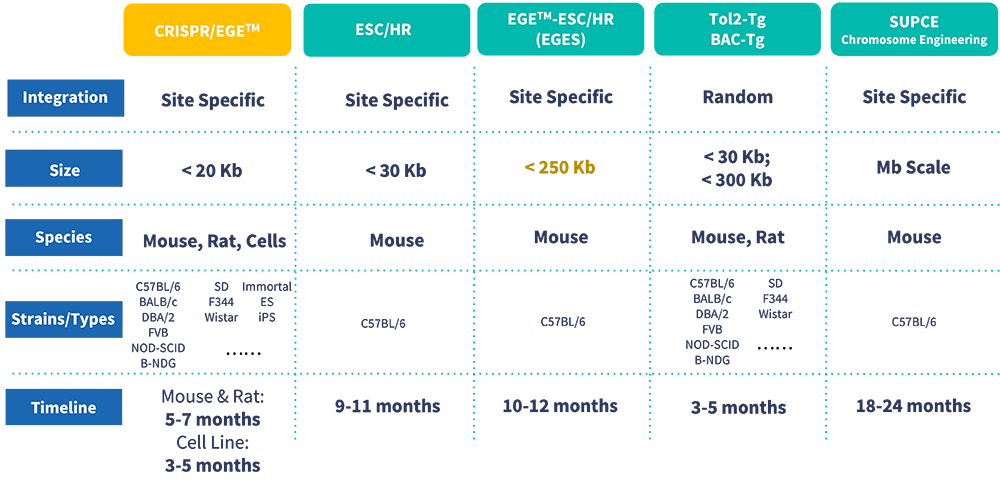
独自のバイオインフォマティクスアプローチにより、標的ゲノム上でsgRNAと類似した配列相同性を持つ領域を検索することで、オフターゲット活性を最小限に抑えます。そのため、高い特異性と高い活性を持つsgRNAのみを選択します。品質管理の一環として、潜在的なオフターゲット部位周辺のゲノム領域を増幅するために2回のPCRを実施し、その後シーケンシングを行ってオフターゲットイベントを検出します。また、ノックインおよびコンディショナルノックアウト動物モデルの作成における重要な品質管理ステップとして、サザンブロット法をワークフローに統合し、潜在的なランダム挿入を検出します。プロジェクト開始後、専任のプロジェクトマネージャーがモデルの進捗状況について毎月報告し、またいつでもご連絡いただけます。

当社の遺伝子編集サービス技術の詳細については、遺伝子編集パンフレットをダウンロードしてください。