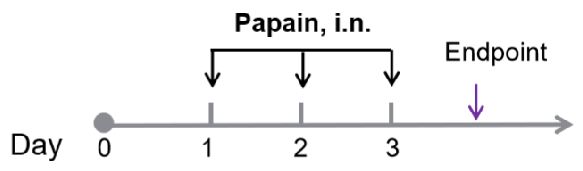
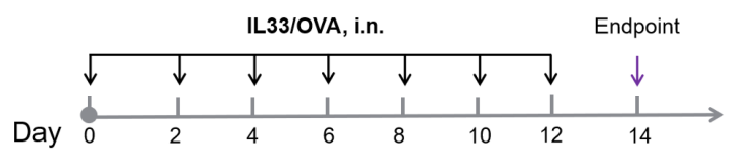
パパイン誘導性急性肺損傷マウスモデルの確立
- 実験動物: B-hTSLP/TSLPR、C57BL/6N、8~10 週齢、雌
- モデル誘導試薬: パパイン(鼻内投与、i.n.)
- モデル誘導方法:
| Readout |
| Included tests |
Bronchoalveolar Lavage Fluid (BALF) |
Cell numbers of Neutrophils, eosinophils, and macrophages |
| Histopathology |
Bronchial mucus |
| Optional tests |
BALF |
IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate |
IL-4, IL-5, IL-13, TARC… |
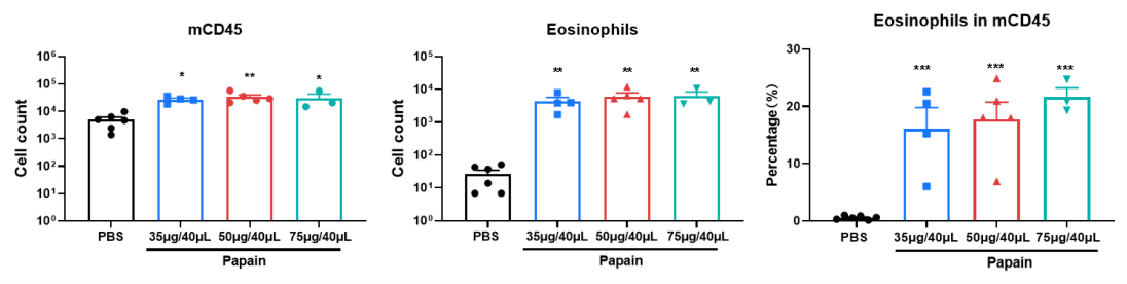
C57BL/6 マウスにおけるパパイン誘導性急性肺損傷マウスモデルの確立
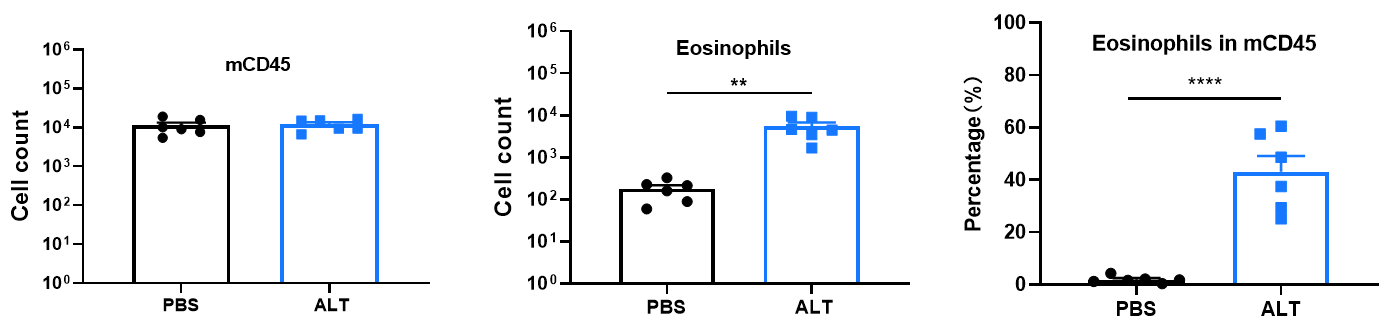
mCD45 および好酸球の数、ならびに mCD45 中の好酸球の割合。 パパイン誘導性急性肺損傷 C57BL/6 マウスモデルの炎症細胞浸潤スコアおよび血管?気管支周囲の粘液スコア。結果は平均 ± SEM で表示。*** p<0.001、p<0.01、p<0.05。
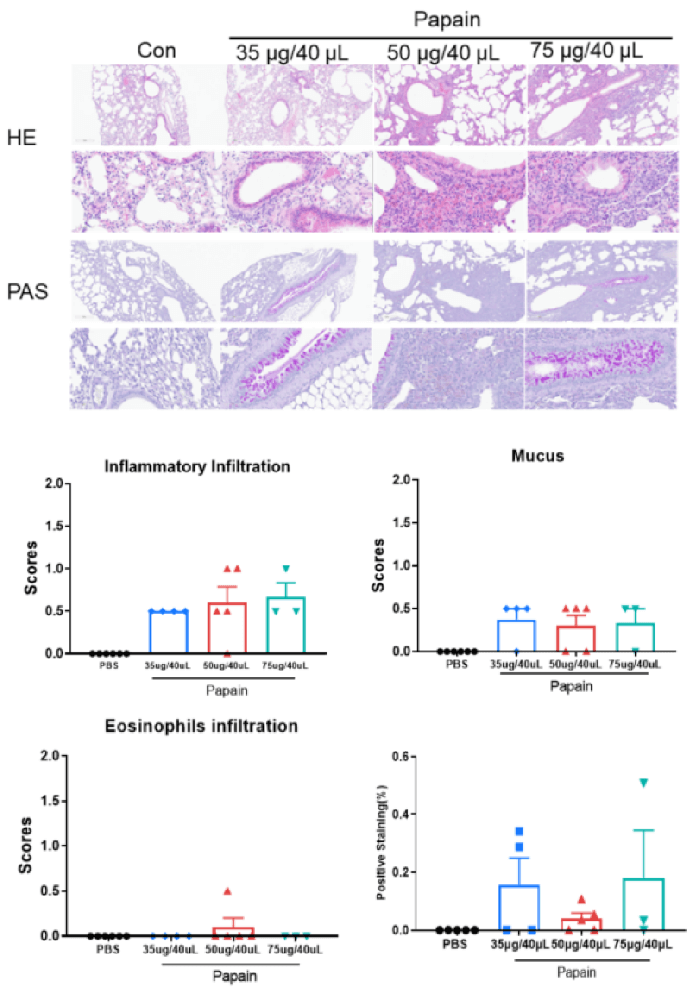
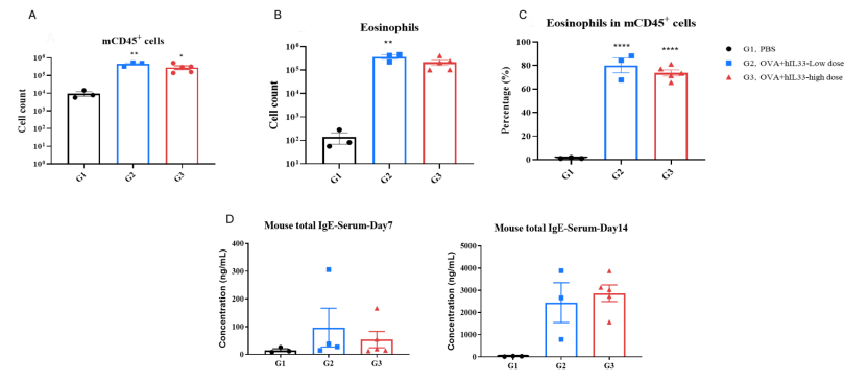
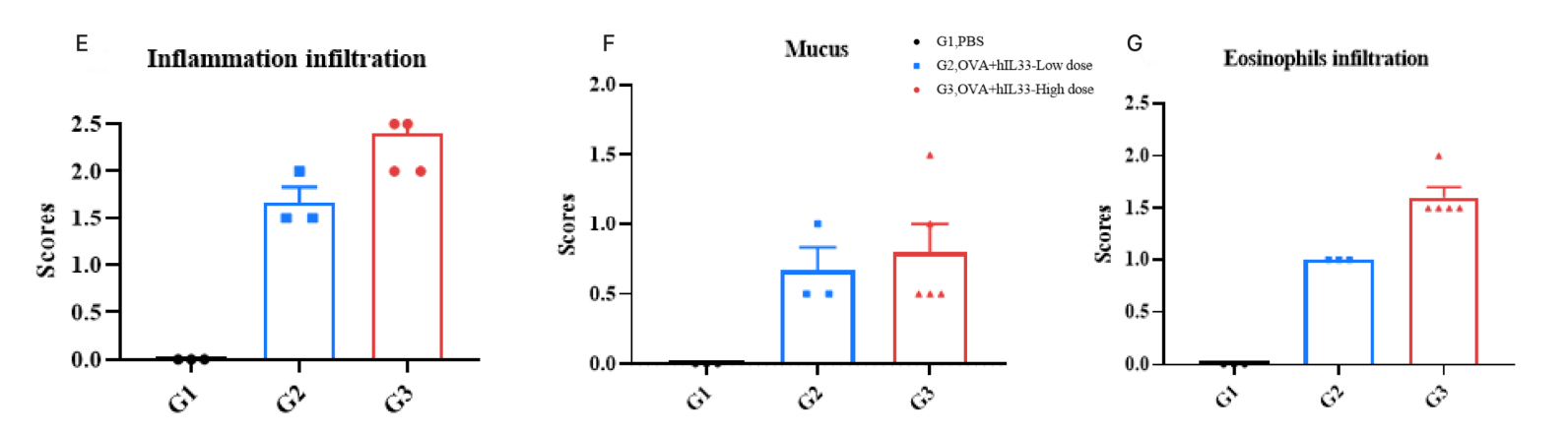
異なる用量群におけるモデル誘導の程度。 C57BL/6N マウスの PBS 対照群(G1)は顕微鏡下で有意な異常は認められませんでした。対照群(G1)と比較して、パパインモデルの 3 つの用量群(G2-35ug/40uL、G3-50ug/40uL、G4-75ug/40uL)は、それぞれ異なる程度の血管および気管支周囲の炎症細胞浸潤、肺気管支内の粘液、ならびに肺血管および気管支周囲の好酸球浸潤を示し、モデル作成が成功したことを示しています。3 つの用量群間にモデル誘導程度の有意差はありませんでした。