このページで
ヘテロ二量体ジフテリア菌外毒素であるジフテリア毒素(DTx)の細胞毒性は、ヘパリン結合性EGF様成長因子前駆体(proHB-EGF、DTRとも呼ばれる)による受容体を介したエンドサイトーシスに厳密に依存することが既に示されています。DTRは、DTxのBサブユニットに結合し、DTxのエンドサイトーシスを促進します。細胞質に侵入すると、DTx Aサブユニットが伸長因子2の不活性化を触媒し、タンパク質合成を終結させ、標的細胞のアポトーシス死を誘導します。DTxを介した細胞アブレーションは、非常に高感度かつ効率的であり、細胞質内に活性型DTx A分子1個が存在するだけで真核細胞を死滅させることができます。ヒト細胞は本来DTxに感受性がありますが、マウス細胞はHB-EGF多型を有し、これがDTxの結合を阻害し、毒素による細胞死を抑制します。一方、霊長類のプロHB-EGF/DTRを遺伝子導入発現させると、抵抗性マウス細胞がDTx感受性となり、体内で多様な毒素誘導性細胞アブレーションを行うシステムとなります。DTR遺伝子導入マウスにおける細胞アブレーションの特異性とタイミングは、細胞種限定プロモーター/エンハンサーエレメントと毒素投与レジメンによって決定できます。免疫細胞枯渇法は、様々な免疫系構成要素の機能的寄与を判定する強力な手法です。この手法は、がん免疫療法が異なる免疫細胞サブセットを介した複数のメカニズムを介して作用することが多いため、がん免疫療法の根底にあるメカニズムを研究するのに特に有用です。
当社は、様々なDTRマウスモデルを提供しています。レポーター遺伝子であるEGFP(Enhanced Green Fluorescent Protein)とルシフェラーゼを導入することで、実験の可視化と定量分析能力が大幅に向上します。この戦略により、マウスにおいてEGFP-DTR-ルシフェラーゼ遺伝子を発現する特定の細胞または組織の動態変化と機能を直接観察することができるようになります。また、生物発光イメージングなどのin vivoイメージング技術を用いることで、生きた状態のマウスにおける特定遺伝子の発現と細胞活動を非侵襲的にモニタリングすることができます。こうした多様な統合により、EGFP-DTR-ルシフェラーゼマウスモデルは、細胞機能、疾患メカニズム、薬物作用メカニズムを理解するための強力なツールとなっています。これらのDTR系統は、特定の免疫細胞集団の標的除去を必要とする試験において、ますます重要な役割を果たしています。これらのDTRモデルは、モノクローナル抗体が通常標的とする細胞表面マーカーを欠損する細胞系の除去に特に有用であり、免疫療法への反応をより深く理解し改善するために用いられる、非常に効率的かつ強力な免疫細胞除去オプションとなります。
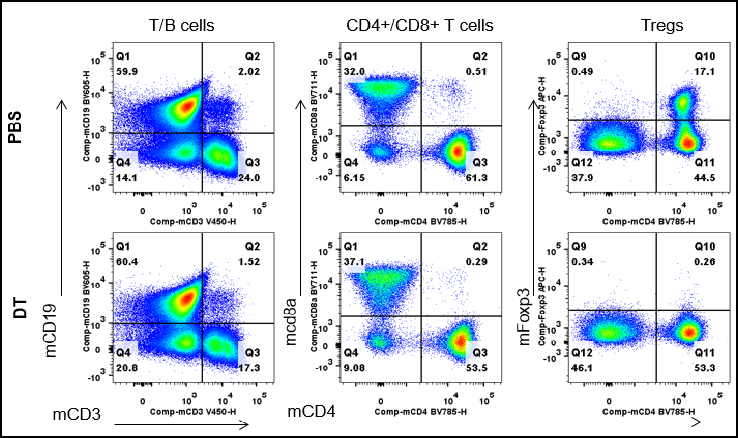
FACSによる脾臓白血球サブポピュレーションの解析 雄のB-Foxp3-EGFP-DTR-Lucマウス(n=3、7ヶ月齢)から脾臓細胞を単離し、PBSまたはDT(30 ng/kg体重)を2日連続で投与しました。フローサイトメトリー解析により、脾臓内の白血球サブポピュレーションを評価しました。DT投与後、Tregは脾臓で著しく減少しました。
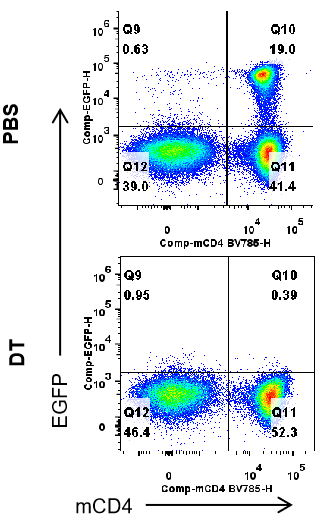
B-Foxp3-EGFP-DTR-Lucマウスの脾臓におけるEGFP発現の解析(FACSによる) B-Foxp3-EGFP-DTR-Lucマウス(n=3、7ヶ月齢)から脾臓細胞を単離し、PBSまたはDT(30 ng/kg体重)を2日連続で投与しました。フローサイトメトリー解析により、T細胞内でのEGFP発現を評価しました。単一の生細胞CD45+細胞はCD3+; CD19-のT細胞集団としてゲーティングされ、さらに解析に使用されました。DT投与後、脾臓でEGFPシグナルは劇的に減少しました。
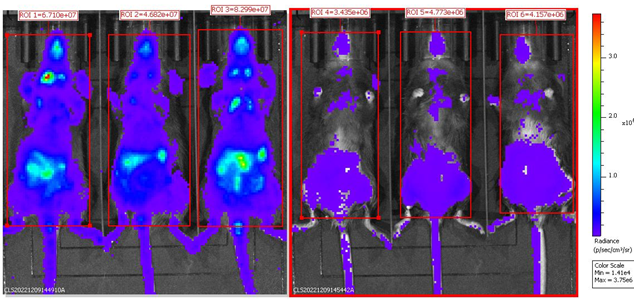
DT投与後のホモ接合体B-Foxp3-EGFP-DTR-LucマウスのBLI解析 ホモ接合体B-Foxp3-EGFP-DTR-LucマウスにPBS(n=3)またはDT(n=3)を2日連続で腹腔内投与し、麻酔下で生物発光イメージングを実施しました。マウスは150mg/kgのD-Luciferinカリウム塩を腹腔内投与後10分でIVIS Lumina LT Inst Series IIIイメージングシステムで撮影されました。生物発光イメージングはTreg細胞の追跡にも使用できます。
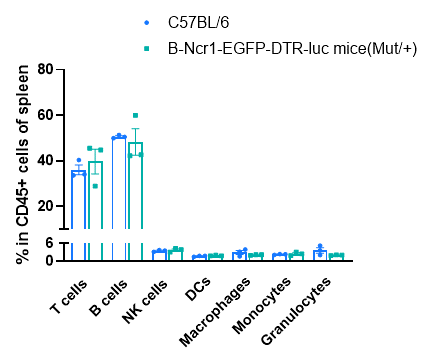
フローサイトメトリー解析による脾臓内の白血球サブポピュレーションの頻度 C57BL/6およびB-Ncr1-EGFP-DTR-Lucマウス(n=3、9週齢)から脾臓細胞を単離し、フローサイトメトリー解析を行って白血球サブポピュレーションの頻度を評価しました。B-Ncr1-EGFP-DTR-LucマウスにおけるT細胞、B細胞、NK細胞、樹状細胞、顆粒球、単球およびマクロファージの割合は、C57BL/6マウスと類似していました。B-Ncr1-EGFP-DTR-Lucマウスの血液およびリンパ節の白血球サブポピュレーションの頻度も、野生型C57BL/6マウスと同様でした(データ未掲載)。値は平均±SEMとして示されています。
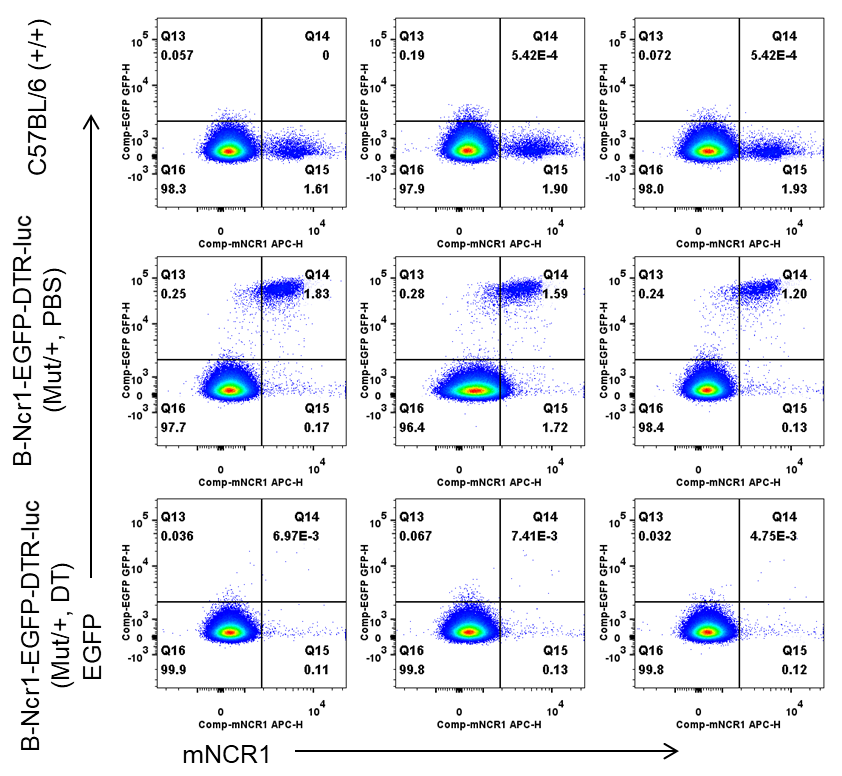
フローサイトメトリー解析による脾臓中のNK細胞内のEGFP+細胞の頻度 野生型C57BL/6マウス(+/+)およびB-Ncr1-EGFP-DTR-Lucマウス(Mut/+)(n=3、8-9週齢)から脾臓細胞を単離し、PBSまたはDT(50ng/kg体重)を4日間連続で投与しました。フローサイトメトリー解析により、NK細胞内のEGFP+細胞の頻度を評価しました。DT投与後、B-Ncr1-EGFP-DTR-LucマウスにおけるNK細胞内のEGFP頻度は減少しました。