このページで
肝臓の線維化は、様々な慢性肝疾患によって引き起こされる肝障害の一般的な結果であり、肝硬変や肝細胞癌などの進行期疾患へと進行する可能性があります。TGF-βやPDGFなど、線維化に関与する主要な分子経路を標的とした治療介入は、有望なアプローチとなっています。これらの標的の研究は、線維化の進行を阻止または改善することを目指しており、肝疾患の治療に希望をもたらします。
当社 は、薬剤評価のために、CCL4 誘発、TAA 誘発、および胆管結紮誘発肝線維症マウスモデルを開発しました。
四塩化炭素(CCl4)誘発性肝線維症および肝硬変のマウスモデルは、肝線維症および肝硬変の研究において広く受け入れられている実験モデルです。これらのマウスモデルは、毒性損傷に関連する多くの部分において、ヒトの疾患パターンを反映しています。例えば、α-SMA発現、星状細胞の活性化、そしてコラーゲン-1、MMP、およびそれらの阻害薬といった主要なマトリックス成分が挙げられます
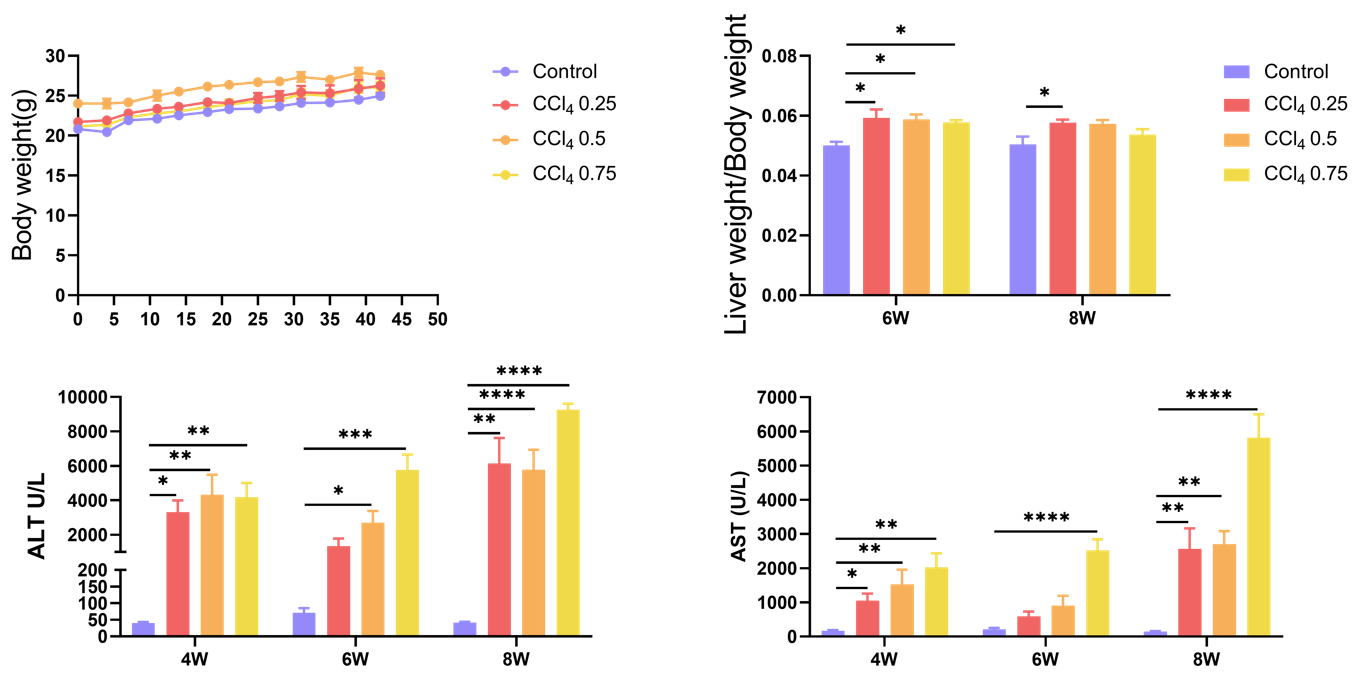
CCL4誘発後、マウスの肝臓重量、体重、血清中のALTおよびASTレベルを検出しました。値は平均±SEMとして表されています。N = 6匹のマウス/群。*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001。
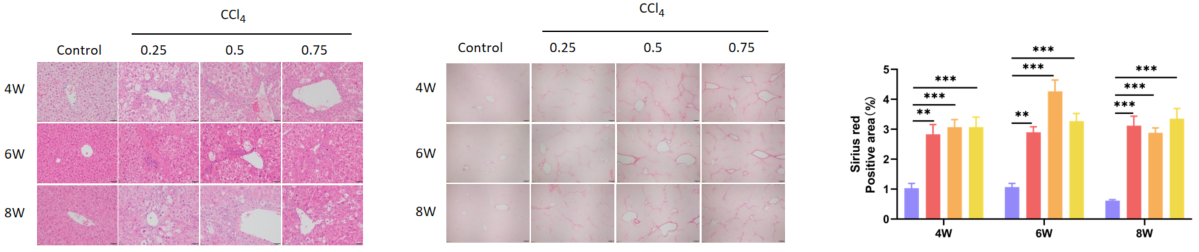
H&E染色による肝臓の炎症浸潤、およびSirius Red染色による肝臓の線維化を示しました。値は平均±SEMとして表されています。N = 6匹のマウス/群。**p<0.01, ***p<0.001。
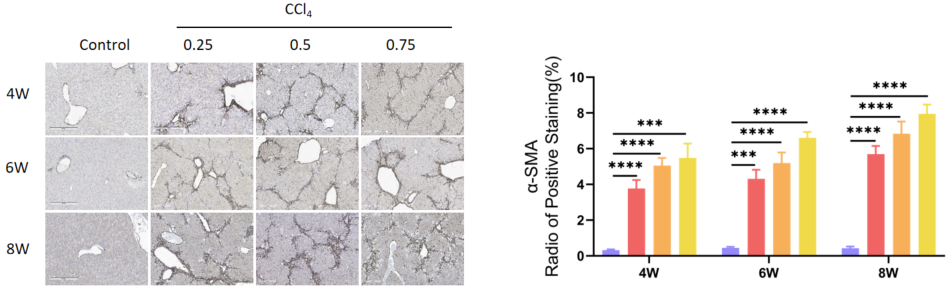
肝臓内の線維芽細胞マーカーα-SMAを示す免疫組織化学。値は平均±SEMで示されています。各群N = 6匹のマウス。***p<0.001、****p<0.0001。
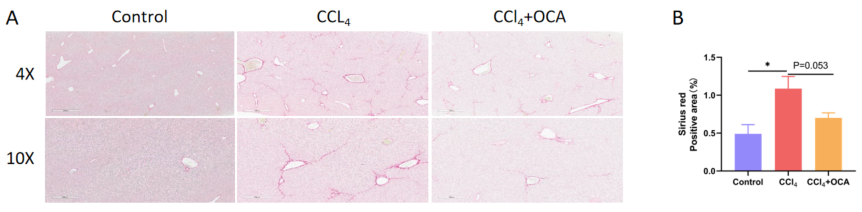
A. CCl4誘導とOCA治療後3週間のSirius赤染色による肝線維症の代表的な画像。B. Sirius赤染色の統計データ。値は平均±SEMで示されています。各群N = 6匹のマウス。*p<0.05。
チオアセタミド(TAA)は、肝線維症の病因で発生する損傷を模倣するために広く使用されている化合物です。TAAは、その代謝産物であるチオアセタミド二酸化硫黄(TASO2)を通じて反応性酸素種(ROS)の生成を増加させ、重度の酸化ストレス、脂質過酸化、およびタンパク質カルボニルとDNA付加物の生成を引き起こします。生成されたROSは、肝星細胞(HSC)の活性化を引き起こし、同時に肝星細胞の筋線維芽細胞様細胞への分化転換を誘導し、EMCの合成と分解の不均衡と継続的な線維化プロセスにつながります。
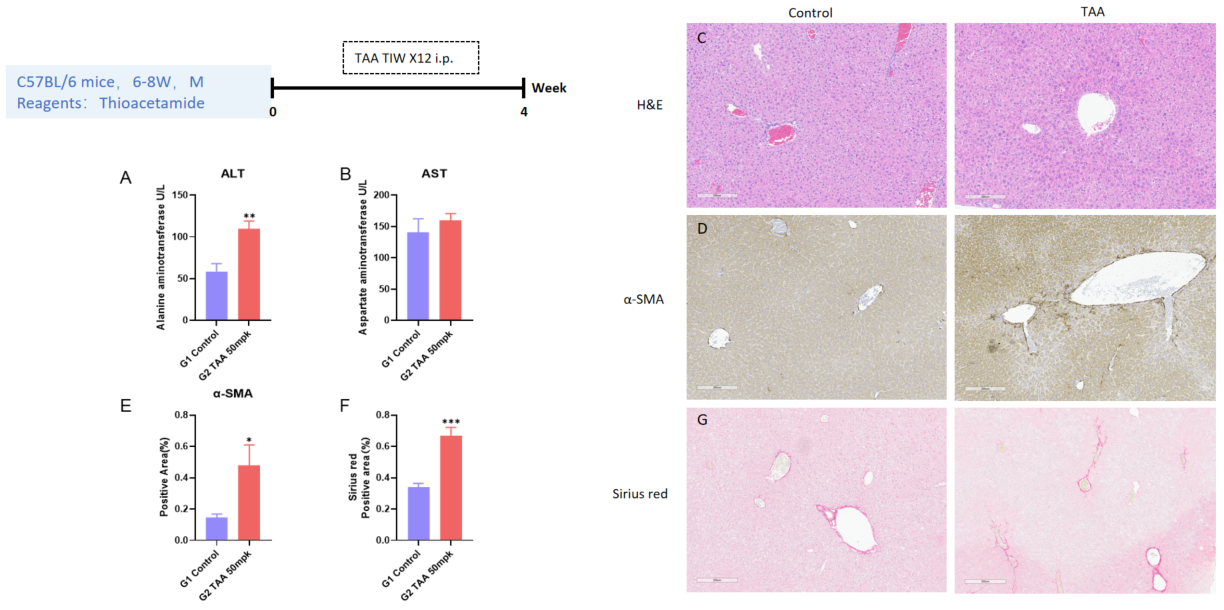
4週間のTAA誘発肝線維症モデル。A-B、血清中のALTおよびASTレベル。C、H&E染色による代表的な画像。D-E、免疫組織化学染色によるα-SMAおよび陽性領域の代表的な画像。G-F、Sirius赤染色による肝線維症の増加および陽性領域の代表的な画像。各群N = 6匹のマウス。*p<0.05、**p<0.01、***p<0.001。
胆管結紮は肝外胆道閉塞を引き起こし、胆管拡張と胆汁うっ滞を引き起こします。胆管内圧がさらに上昇すると、肝内胆管が拡張・破裂し、拡張した胆管と漏出した胆汁によって肝内血管が圧迫され、肝細胞は虚血・壊死に陥り、線維組織が増殖して肝小葉を囲み、肝細胞周囲に広がり、最終的には肝硬変に至る可能性があります。
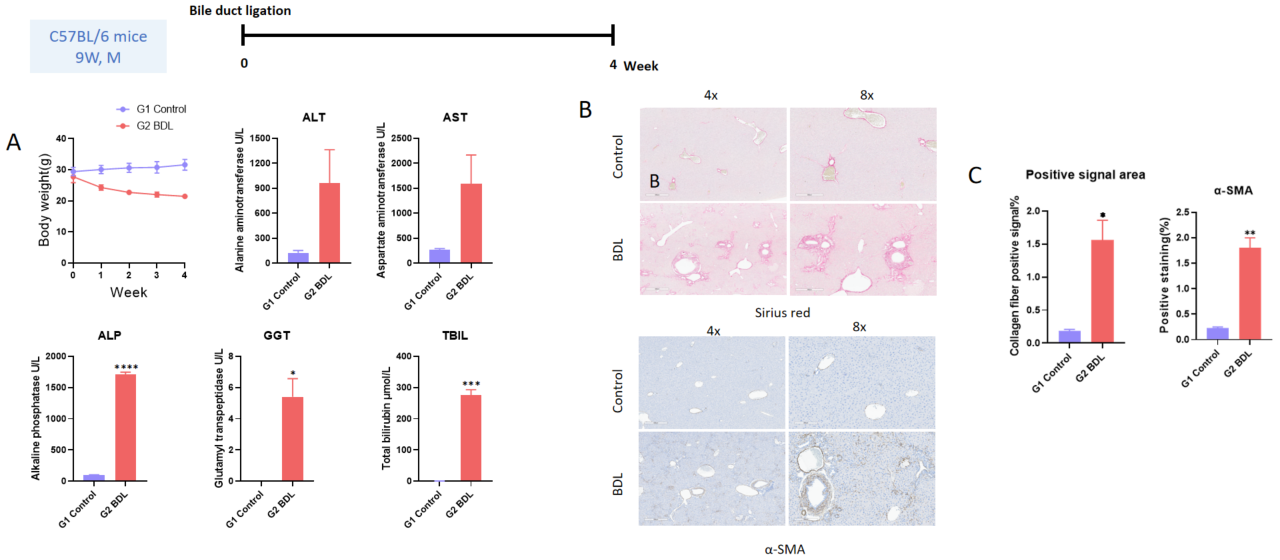
胆管結紮による肝線維症モデル4週間。A、血清中のALT、AST、ALP、GGTおよびTBILレベル。B、Sirius赤染色および免疫組織化学染色による肝線維症の増加とα-SMA陽性領域の代表的な画像。C、コラーゲン繊維の陽性信号領域。各群N = 6匹のマウス。*p<0.05、**p<0.01、***p<0.001。