このページで
アテローム性動脈硬化症は、血管内皮機能不全、炎症細胞の浸潤、そして徐々に進行するアテローム性プラークの形成を特徴とする動脈壁の慢性炎症性疾患です。アテローム硬化の過程において、脂質代謝異常(低密度リポタンパク質(LDL)の増加と高密度リポタンパク質(HDL)の減少)がアテローム性プラークの形成につながる可能性があります。
当社は、脂質代謝異常に対する抗体薬や核酸医薬などの新規医薬品のテスト、ならびに疾患メカニズムの研究用として、脂質代謝をターゲットにしたヒト化マウスを開発しました。
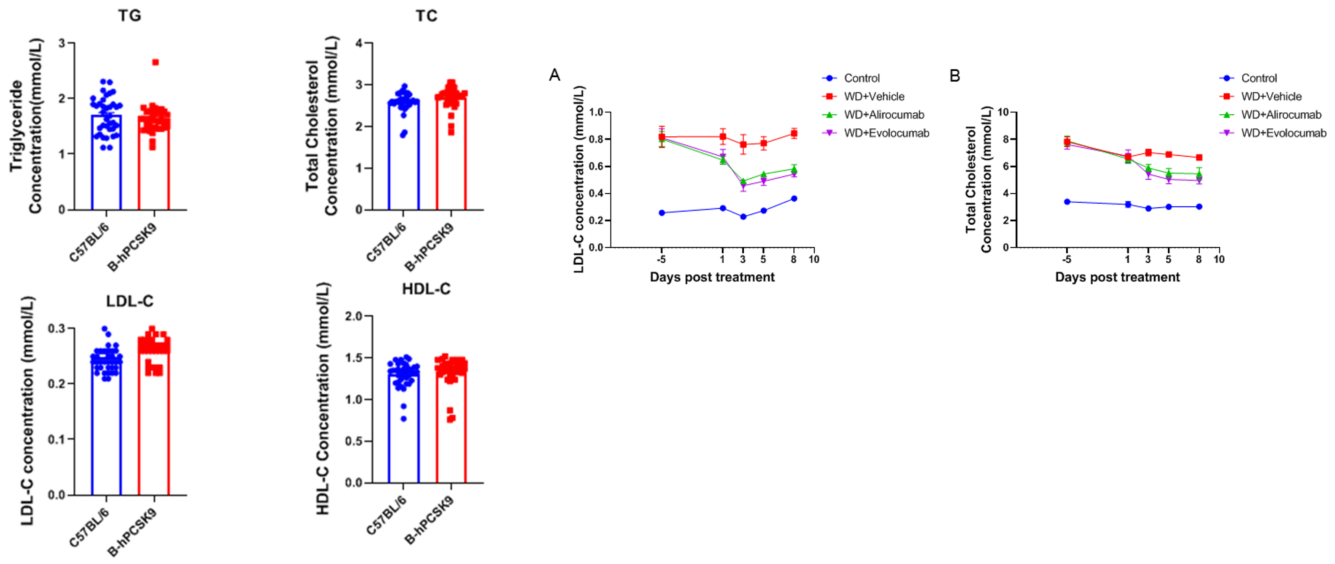
B-hPCSK9マウス(雄)における脂質代謝に対する抗ヒトPCSK9抗体の有効性 野生型C57BL/6およびB-hPCSK9マウスに、6週間高カロリーな食餌を与えた後、Alirocumab(in house)/Evolocumab(in house)またはアイソタイプコントロール抗体(1回投与、皮下注射)(n = 8)を投与しました。血液は、-5日、1日目、3日目、5日目、8日目に採取、分析されました。抗ヒトPCSK9抗体を投与された雄のマウス群では、LDL-C(A)およびTC(B)の血清レベルがコントロールアイソタイプ群と比較して低下しました。結果は、抗ヒトPCSK9抗体が雄のB-hPCSK9マウスの血糖値制御に効果的であることを示しています。値は平均±標準誤差(SEM)で示されます。TC、総コレステロール、LDL-C、低密度リポタンパク質コレステロール。
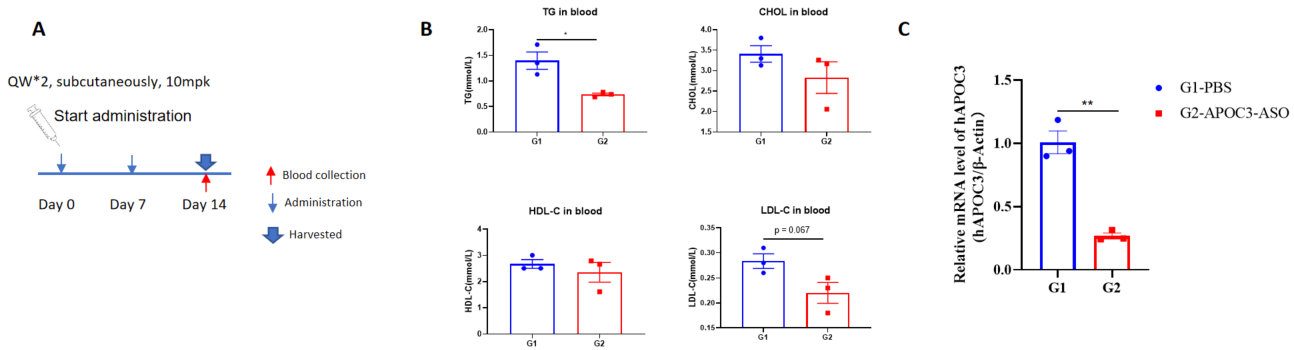
B-hAPOC3マウスにおけるヒトAPOC3に対する核酸医薬の有効性 B-hAPOC3マウスはランダムに2群に分けられ(n = 3 /群、6週齢)、ヒトAPOC3をターゲットにした核酸医薬品(特許に基づいて合成)とPBSをそれぞれマウスに投与しました(核酸薬はPBS水溶液の形で投与しました)。全てのマウスの薬物投与量は、体重に基づいて計算されました。投与後14日目に肝臓組織を採取し、qPCRを用いてヒトAPOC3 mRNAの発現レベルを検出しました。A、実験処理の示意図。B、治療後のB-hAPOC3マウスの血糖値レベル。コントロール群(G1)と比較して、治療群(G2)ではTGが有意に減少しました。C、肝臓におけるヒトAPOC3 mRNAの発現。治療群(G2)ではヒトAPOC3が有意に減少し、コントロール群(G1)と比較して抑制率は73.4%でした。これにより、B-hAPOC3マウスがヒトAPOC3をターゲットにした核酸医薬品のin vivo評価に強力な前臨床モデルを提供することが示されました。値は平均±標準誤差(SEM)で示されます。
ApoE-/-マウスにおける特殊食によって誘発された動脈硬化モデル
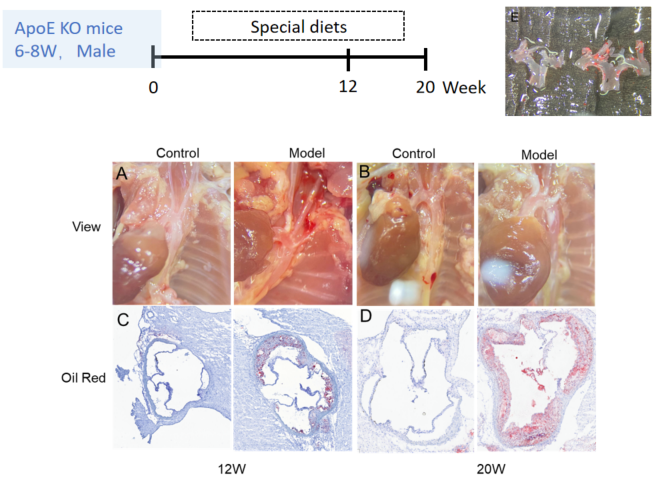
特殊食によって誘発された動脈硬化モデル A-B、12週および20週のマウスにおける動脈硬化性プラーク。C-D、12週および20週の大動脈洞のオイルレッド結果。E、12週の大動脈弓の組織染色。各群のN = 8匹。
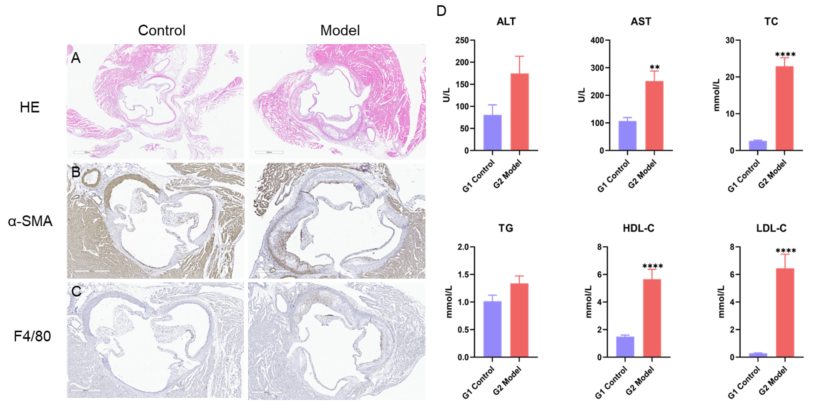
12週目の動脈硬化マウスモデルの組織染色および血液生化学検査 A、大動脈洞のH&E結果。B-C、免疫組織化学でα-SMAおよびF4/80の発現を示します。D、血清中のALT、AST、TC、TG、HDL-CおよびLDL-Cレベル。値は平均±標準誤差(SEM)で示されます。各群のN = 8匹。**p<0.01、****p<0.0001。