このページで
腫瘍抗原は、患者から採取した腫瘍細胞、腫瘍関連タンパク質やペプチド、腫瘍抗原を発現する遺伝子など、様々な形態を人工的に合成し、アジュバントと組み合わせたり、樹状細胞を送達キャリアとして利用したりすることで、ワクチン製剤として調製することができます。ワクチンが体内に入ると、腫瘍抗原は樹状細胞に取り込まれ、その後処理されてT細胞に提示され、抗原特異的な細胞傷害性T細胞を活性化して腫瘍を攻撃します。最も理想的な腫瘍特異抗原は、腫瘍細胞の遺伝子変異によって生成され、正常組織では発現しない新抗原です。これは細胞表面に提示され、MHC分子に結合してT細胞によって認識されます。
ワクチンは、純粋な予防手段から治療用途へと進化を遂げ、従来のタンパク質ワクチンやペプチドワクチンから先進的なmRNAワクチンまで、多岐にわたる種類が存在します。当社は、HLAヒト化マウスおよびHLAヒト化腫瘍細胞株を基盤とした、様々な免疫原性評価モデルおよび腫瘍効果モデルを開発しました。これらのモデルは、マウス抗原提示細胞(APC)がヒトと類似または同一のペプチドエピトープを提示・認識することを可能にし、腫瘍ワクチンの開発を加速させます。また、ワクチンの免疫原性、効果、作用機序、安全性を総合的に評価するための最先端のin vivoおよびin vitroプラットフォームも構築しています。
| Immunogenicity validation | Efficacy validation | MOA exploration |
|
|
|
ワクチン評価のための動物モデル:
同系モデル:
異種移植モデル:
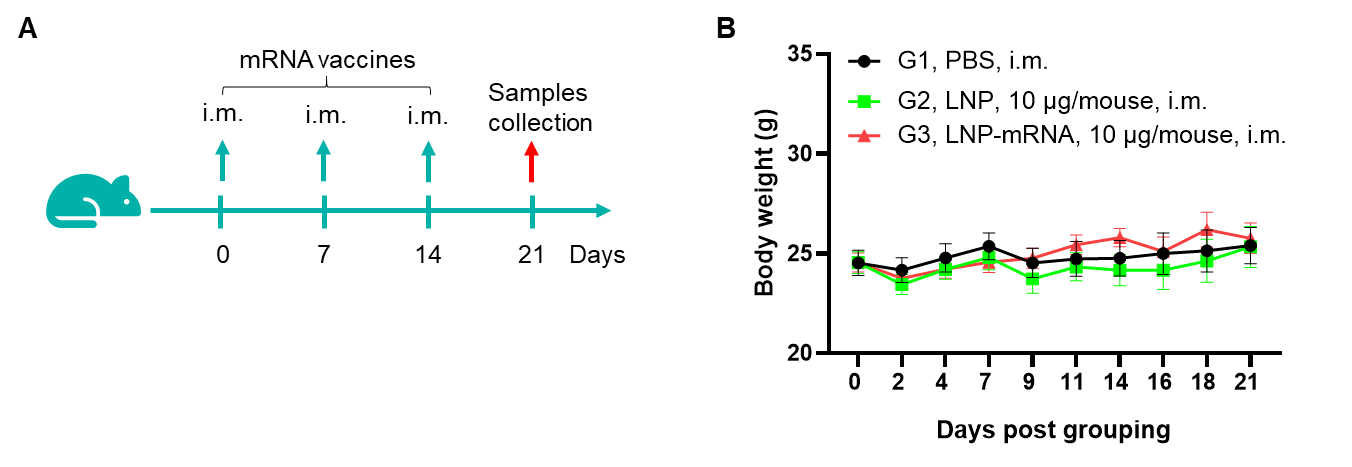
図1. B-HLA-A2.1マウスにおけるmRNAワクチン誘導免疫応答の検出 6〜8週齢の雌B-HLA-A2.1マウスをPBS群とmRNAワクチン群(各群n = 6)に分け、両足の筋肉にPBSまたはワクチンを接種しました。最終免疫の1週間後に脾細胞を採取して、個々のペプチドまたはターゲットに関係ないポリペプチド(ネガティブコントロール(NC))で刺激し、その後IFN-γ分泌および抗原特異的T細胞を測定しました。(A)実験計画。(B)群間で体重に有意差なし。値は平均±SEMとして示されています。
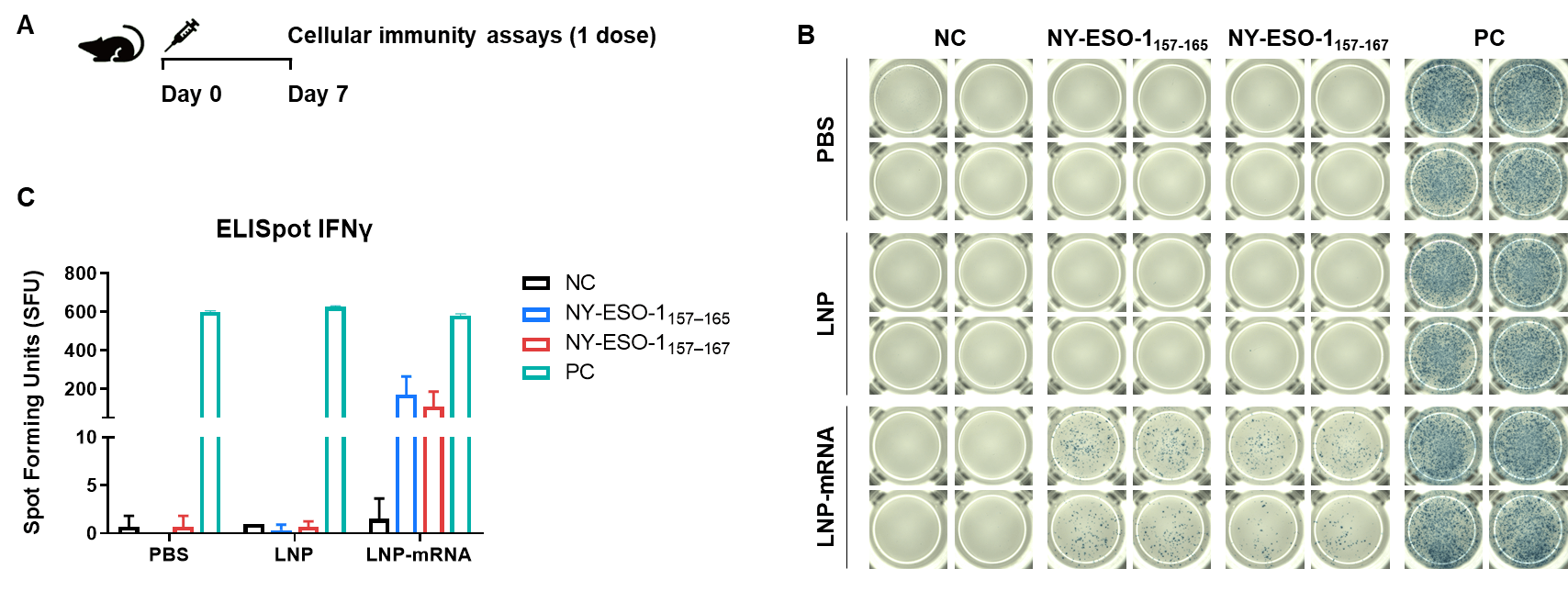
図2. IFN-γ ELISpotアッセイによるB-HLA-A2.1マウスのmRNAワクチン誘導免疫応答の検出 (A)ワクチン接種および検査の計画。9〜10週齢の雄B-HLA-A2.1マウスをPBS群、LNP群、LNP-mRNA群(各群n = 3)に分け、両足の筋肉にPBS、LNP、またはLNP-mRNAを1回接種しました。免疫後1週間後に脾細胞を採取して、個々のペプチドで刺激し、ペプチドなしをネガティブコントロールとして、またはPMA/Ionomycinをポジティブコントロールとして使用し、IFN-γ分泌を測定しました。(B)免疫化されたマウスから採取した脾細胞で、ネガティブコントロール、ペプチドワクチン、またはポジティブコントロールによる刺激の代表的な結果。(C)結果のまとめ。値は平均±SEMとして示されています。NC: ネガティブコントロール。PC: ポジティブコントロール。(実験番号:24P037503)

図3. IFN-γ ELISpotアッセイによるB-HLA-A2.1マウスのmRNAワクチン誘導免疫応答の検出 (A)ワクチン接種および検査の計画。9〜10週齢の雄B-HLA-A2.1マウスをPBS群、LNP群、LNP-mRNA群(各群n = 3)に分け、両足の筋肉にPBS、LNP、またはLNP-mRNAを3回接種しました。最終免疫の1週間後に脾細胞を採取して、個々のペプチドで刺激し、ペプチドなしをネガティブコントロールとして、またはPMA/Ionomycinをポジティブコントロールとして使用し、IFN-γ分泌を測定しました。(B)免疫化されたマウスから採取した脾細胞で、ネガティブコントロール、ペプチドワクチン、またはポジティブコントロールによる刺激の代表的な結果。(C)結果のまとめ。値は平均±SEMとして示されています。NC: ネガティブコントロール。PC: ポジティブコントロール。(実験番号:24P037503)
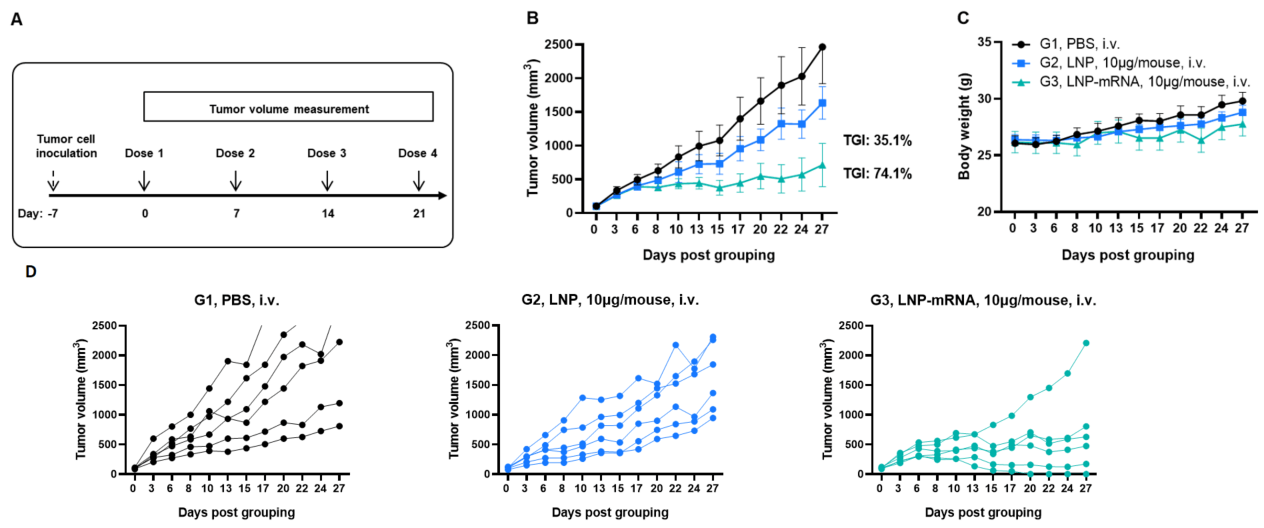
図1. 同系腫瘍に対するLNP-mRNAの抗腫瘍活性 (A)実験計画。(B)LNPまたはLNP-mRNAでの治療による抗腫瘍活性。B-HLA-A2.1マウス(n = 6/群)はPBS、LNP、またはLNP-mRNA(10 μg/マウス)でワクチン接種されました。B-HLA-A2.1/hNY-ESO-1 MC38細胞はマウスの右側腹部に接種されました。(C)治療中の体重変化。図Bに示すように、LNP-mRNAはB-HLA-A2.1マウスで腫瘍成長を制御するのに有効でした。(D)個々のマウスでのB-HLA-A2.1/hNY-ESO-1 MC38腫瘍細胞の成長。値は平均±SEMとして示されています。(実験番号:24P037502)
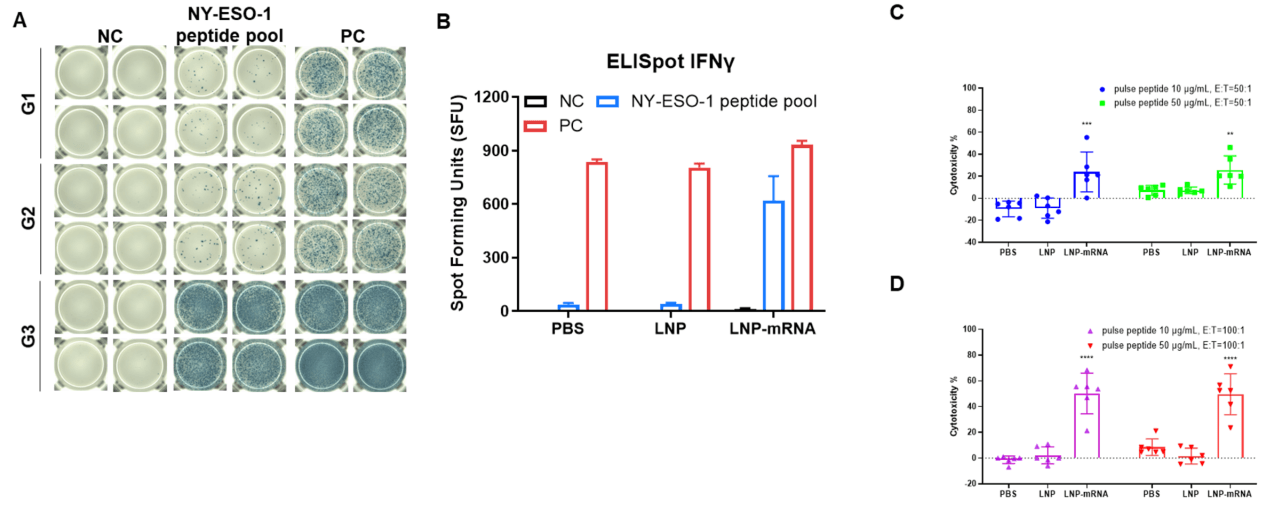
図2. (AおよびB)IFN-γ ELISpotアッセイによるB-HLA-A2.1マウスのワクチン誘導免疫応答の検出 NC: ネガティブコントロール。PC: ポジティブコントロール。(CおよびD)B-HLA-A2.1マウスから単離されたCTLのNY-ESO-1ペプチドに対する細胞傷害性試験。NY-ESO-1ペプチドでパルスされたB-HLA-A2.1/hNY-ESO-1 MC38細胞に対するCTLの細胞傷害活性は、LDH放出アッセイで、エフェクター-ターゲット比50:1または100:1で、2つの異なるペプチド濃度(10μgまたは50μg)で検出されました。値は平均±SEMとして示されています。統計分析は、PBS群と比較して各治療群を一次元配置分散分析およびDunnettの多重比較検定を使用して行いました。**p<0.01, ***p<0.001, ****p<0.0001。
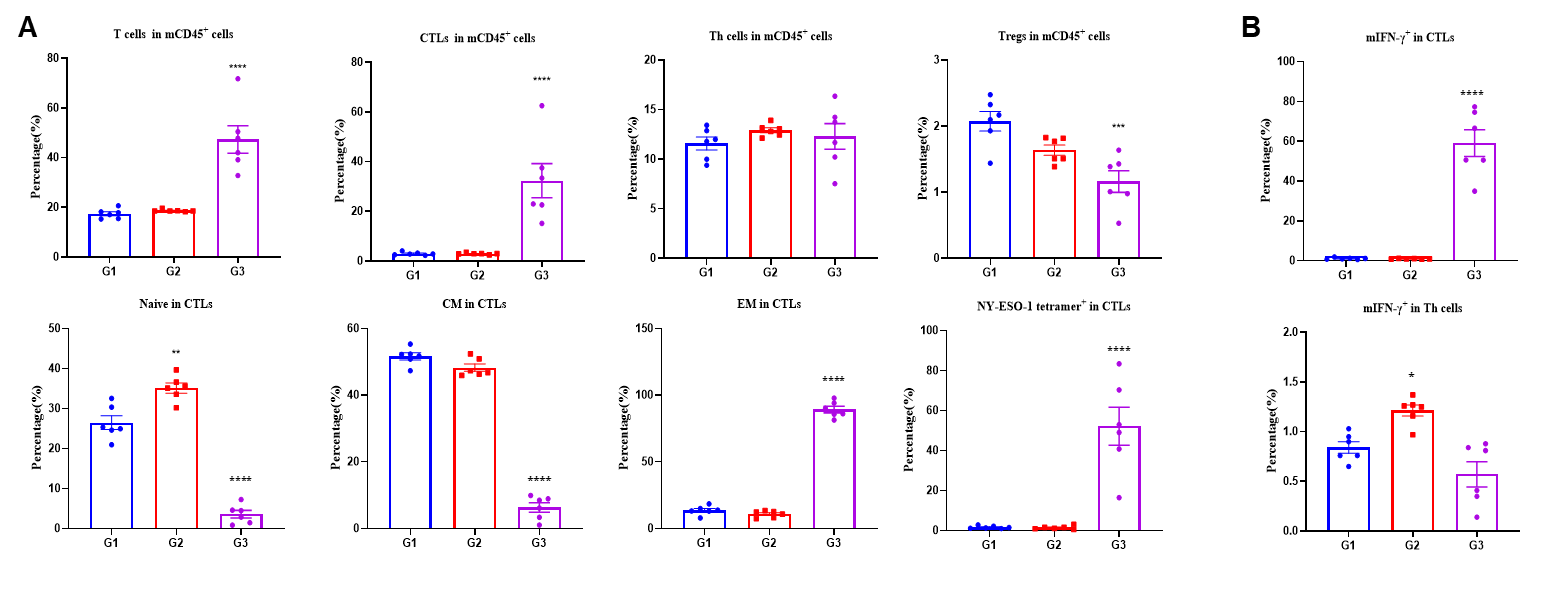
図3. ワクチン接種による脾臓での特異的なエフェクターCD8+T細胞の生成 PBS、LNP、LNP-mRNAワクチンで免疫化されたB-HLA-A2.1/hNY-ESO-1 MC38腫瘍を有するマウスの脾臓から。 (A) フローサイトメトリーアッセイによる脾臓のCD8+T、CD4+T、Treg細胞の分析。脾臓T細胞およびCD8+T細胞の割合は有意に増加しました。mRNAワクチンは、脾臓の総CD8+T細胞の約50%をテトラマー+CD8+T細胞として生成しました。CD8+ T 細胞は、ナイーブおよび中枢記憶では明らかに低い頻度を示し、主にエフェクター記憶に局在していました。(B)NY-ESO-1ペプチドで刺激された免疫化されたマウスから単離された脾細胞の細胞内サイトカイン染色。mIFN-γは主にCD8+T細胞で分泌され、CD4+T細胞では分泌されませんでした。値は平均±SEMとして示されています。統計分析は、PBS群と比較して各治療群を一元配置分散分析およびダネットの多重比較検定を使用して行いました。*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001。
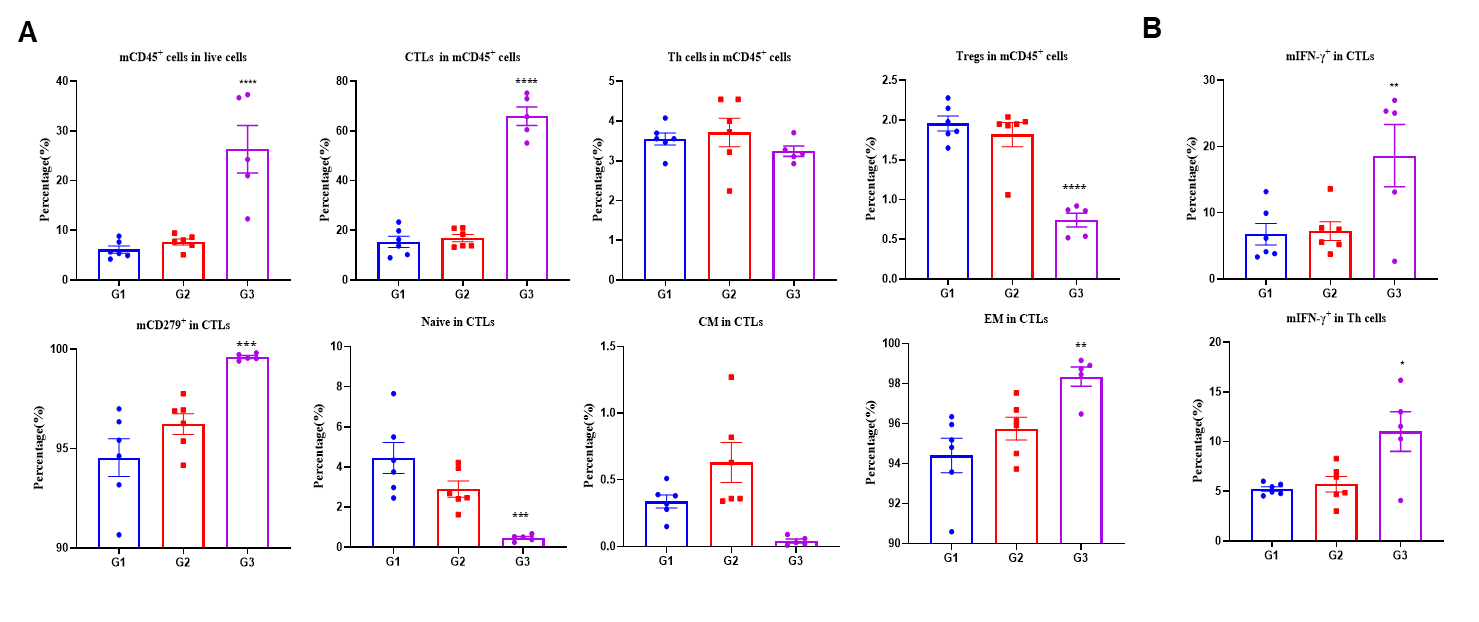
図4. 抗腫瘍T細胞のレパートリーにおけるLNP-mRNAの増加 PBS、Empty LNP、またはLNP-mRNAで免疫化されたB-HLA-A2.1/hNY-ESO-1 MC38腫瘍を有するマウスからの腫瘍。 (A) フローサイトメトリーアッセイによる腫瘍浸潤T細胞およびCD8+T細胞の分析。腫瘍浸潤T細胞およびCD8+T細胞の割合は有意に増加しました。一方、Treg細胞の頻度はLNP-mRNA群で有意に減少しました。腫瘍浸潤CD8+T細胞は未熟および効果記憶(EM)CD8+T細胞の頻度が有意に増加しました。(B)NY-ESO-1ペプチドで刺激された免疫化されたマウスから単離された腫瘍浸潤細胞(TIL)の細胞内サイトカイン染色。mIFN-γはCD8+T細胞およびCD4+T細胞の両方から分泌されました。値は平均±SEMとして示されています。統計分析は、PBS群と比較して各治療群を一元配置分散分析およびダネットの多重比較検定を使用して行いました。*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001。
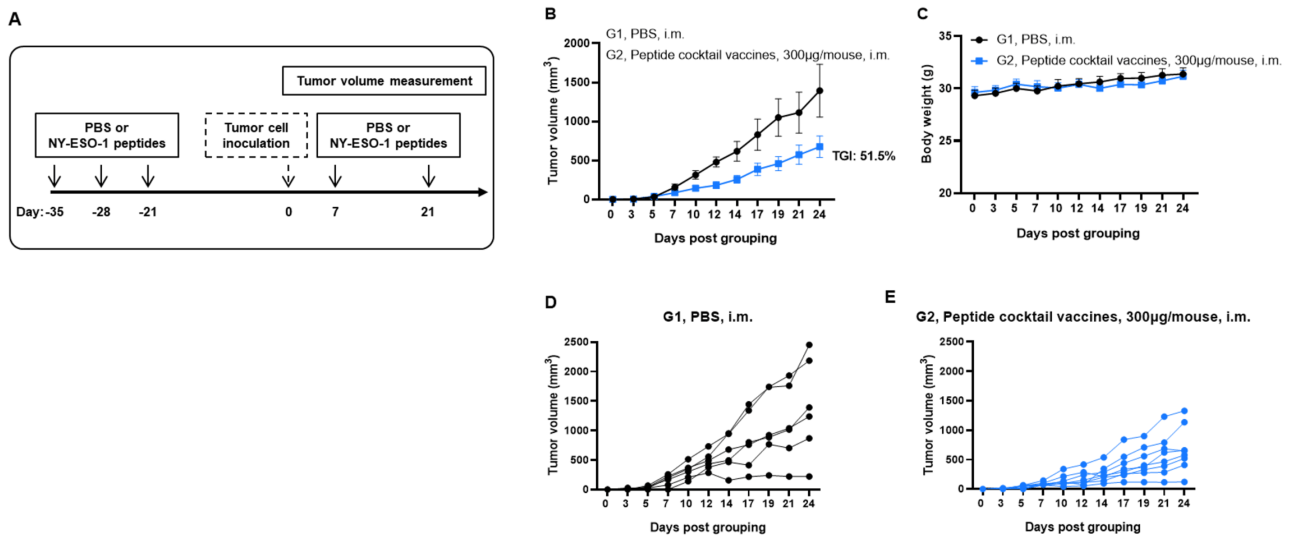
図1. 同系腫瘍に対するNY-ESO-1ペプチドの抗腫瘍活性 (A)実験計画。(B)NY-ESO-1ペプチドによる予防的治療での抗腫瘍活性。B-HLA-A2.1マウス(n = 6または8/群)はPBSまたはNY-ESO-1ペプチド(300 µg)でワクチン接種されました。最終免疫後3週間で、B-HLA-A2.1/hNY-ESO-1 MC38細胞がマウスの右側腹部に接種されました。(C)治療中の体重変化。図Bに示すように、NY-ESO-1ペプチドはB-HLA-A2.1マウスで腫瘍成長を制御するのに有効でした。(DおよびE)個々のマウスの腫瘍成長曲線。値は平均±SEMとして示されています。
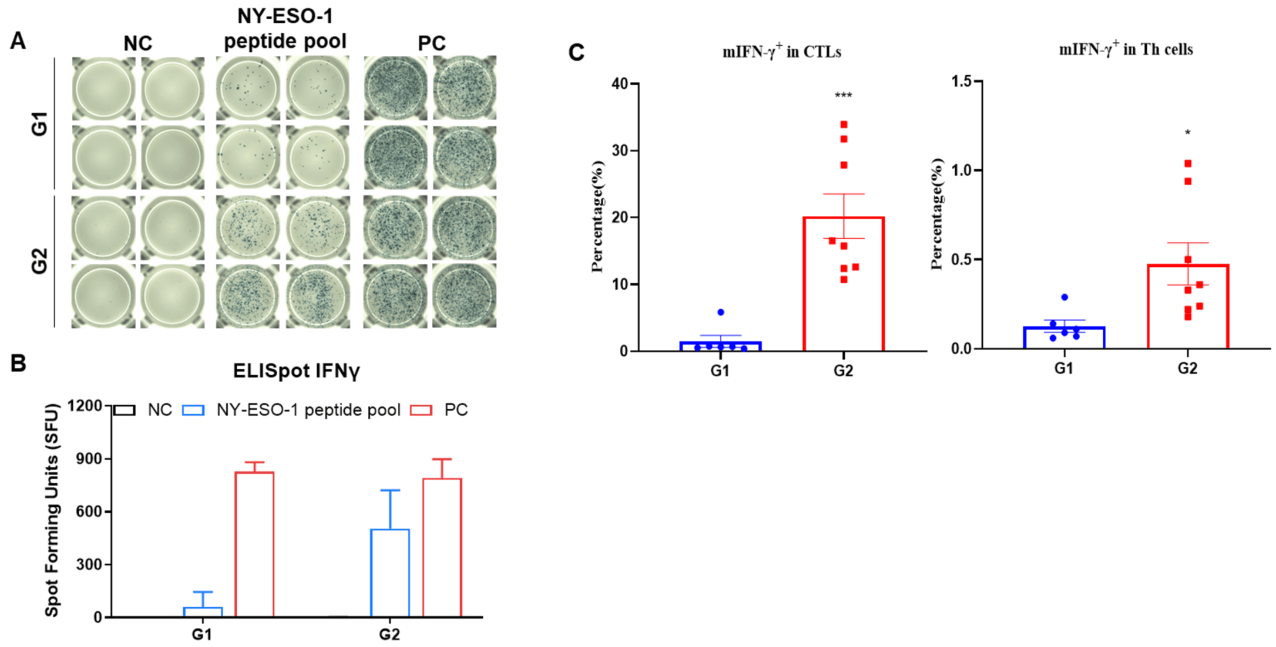
図2.(A)免疫化されたマウスから採取した脾臓細胞をネガティブコントロールまたはペプチドワクチンで二重に刺激したことを示す代表的な結果。(B)結果のまとめ。(C)mIFN-γは主にCD8+T細胞から分泌され、CD4+T細胞からは分泌されませんでした。値は平均±SEMとして示されています。統計的有意性はT検定によって決定されました。(*p<0.05, ***p<0.001 vs G1)。

図3. ペプチドワクチンによる脾臓での特異的エフェクターCD8+ T細胞の生成 PBS、ペプチドカクテルワクチンで免疫された、B-HLA-A2.1/hNY-ESO-1 MC38腫瘍保有マウスの脾臓。フローサイトメトリーアッセイにより、脾臓中のCD8+T、CD4+ T、およびTregの分析を行いました。脾臓T細胞およびCD8+T細胞では、割合(CD45+細胞中)が有意に上昇しました。ペプチドワクチンは、脾臓中の総CD8+ T細胞の約20%でテトラマー+ CD8+ T細胞の頻度を生成しました。CD8+ T細胞は、ナイーブ記憶および中枢記憶において明らかに低い頻度を示し、主にエフェクター記憶に局在していました。値はG1との比較において、平均±SEMとして表されます。統計的有意性はT検定によって決定されました。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
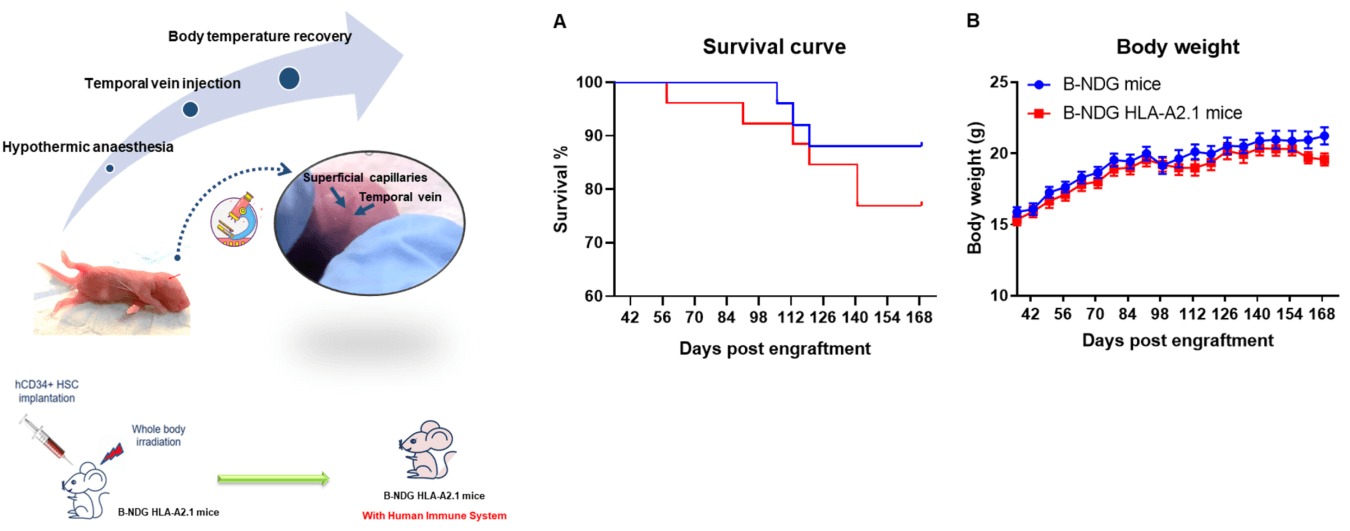
図1. ヒトCD34+HSCのB-NDG HLA-A2.1マウスへの移植 ヒトCD34+造血幹細胞を、0.8 Gyの放射線照射を受けたB-NDG HLA-A2.1マウスおよびB-NDGマウスの新生マウスにそれぞれ移植しました。(A) B-NDG HLA-A2.1マウスは、B-NDGマウスよりもわずかに生存率が低かったものの、統計的に有意な差は認められませんでした。(B) 体重。値は平均値±標準誤差として表されています。
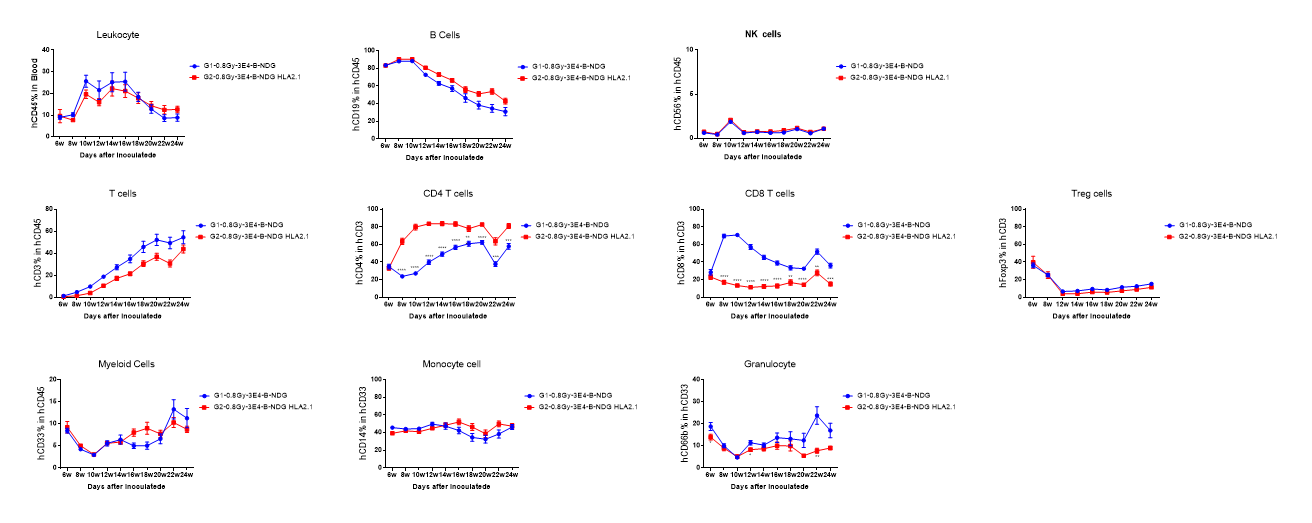
図2. ヒトCD34+HSCのB-NDG HLA-A2.1マウスへの移植 ヒトCD34+HSCを、放射線照射を0.8Gyで行った新生マウスのB-NDG HLA-A2.1マウスおよびB-NDGマウスにそれぞれ移植しました。ヒト白血球をフローサイトメトリーで解析した結果、B-NDG HLA-A2.1マウスのhCD8 + T細胞の割合は、B-NDGマウスと比較して有意に低かったものの、再構成後24週間以内では約18%で維持されることが示されました。B-NDG HLA-A2.1マウスのhCD4 + T細胞の割合は、B-NDGマウスと比較して有意に高く、B-NDG HLA-A2.1マウスにおけるその他の再構成細胞の割合は、B-NDGマウスと同様でした。値は平均値±標準誤差(SEM)で表されています。統計解析は、各治療群をG1と比較したt検定を用いて行いました。*p<0.05、**p<0.01、***p<0.001、****p<0.0001)。
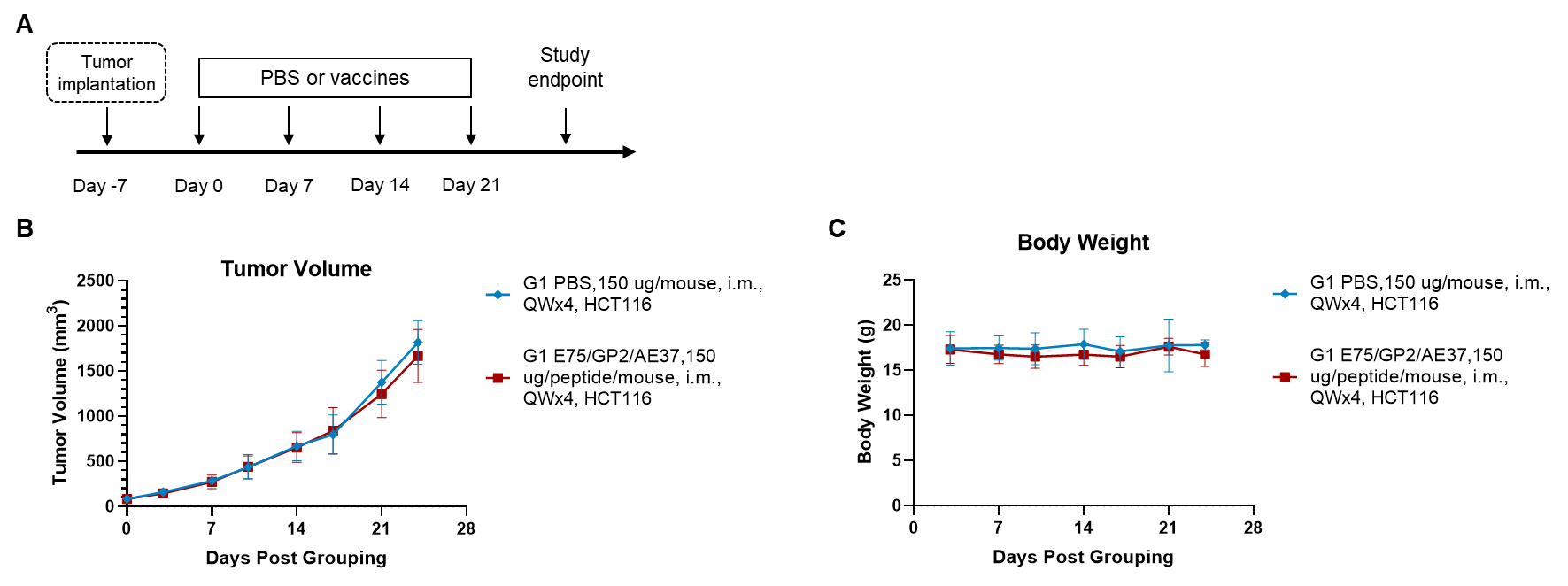
図1. 異種移植腫瘍におけるペプチドワクチンの抗腫瘍活性 (A) 実験計画。(B) ワクチンによる予防治療の抗腫瘍活性。HCT-8細胞は、B-NDG hB2M/HLA-A2.1マウス(HSC再構築)右腹部に接種されました。B-NDG hB2M/HLA-A2.1マウス(HSC再構築)(n = 8/群)は、ペプチドワクチンで免疫化されました。(C) 東予中の体重変化。値は平均±SEMとして示されています。
ワクチンEx vivo評価

mCD3e抗体で刺激した脾細胞のIFN-γ ELISpotアッセイ

IFN-γ ELISpotアッセイの統計的ヒストグラムとプレートビュー C57BL/6マウスから得た脾細胞は、5.00×104-2.50×105/ウェルの密度で播種されました。スポット数は、mCD3e抗体で刺激された脾細胞から生成されたIFN-γの量を示し、免疫細胞活性化レベルに関する情報を提供します。値は平均±SEMとして示されています。
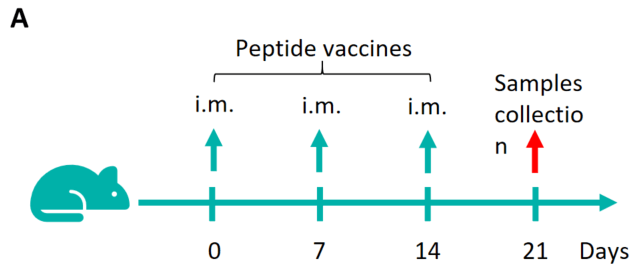
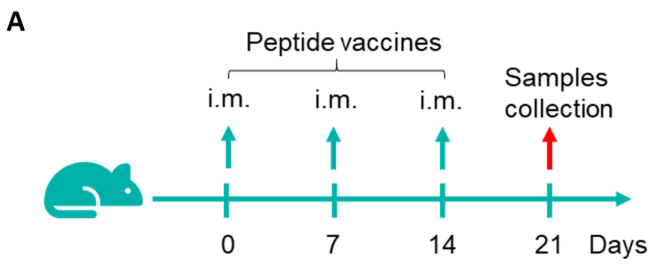
図1. B-HLA-A2.1マウスにおけるペプチドワクチンによる免疫応答(mIFN-γ ELISpotアッセイ) 6〜8週齢の雌B-HLA-A2.1マウスをPBS群とペプチドワクチン群(n = 6)に分け、それぞれの両足筋にPBSまたはワクチンを接種しました。最後の免疫から1週間後、脾細胞を採取し、個別のペプチドまたはターゲット非関連ポリペプチドをネガティブコントロール(NC)として刺激し、IFN-γ分泌および抗原特異的T細胞を測定しました。(A) 実験計画。(B) 免疫化されたマウスから採取した脾細胞の刺激結果の代表的な結果(ネガティブコントロール、ペプチドワクチン、またはポジティブコントロールで2重複)。(C) 結果のまとめ。値は平均±SEMとして示されています。
NC: ネガティブコントロール PC: ポジティブコントロール
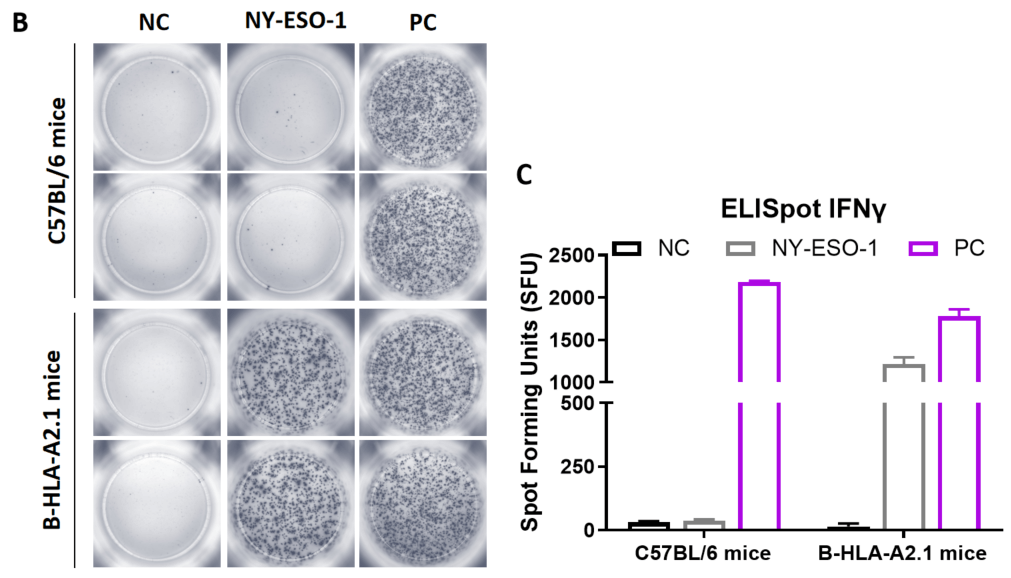
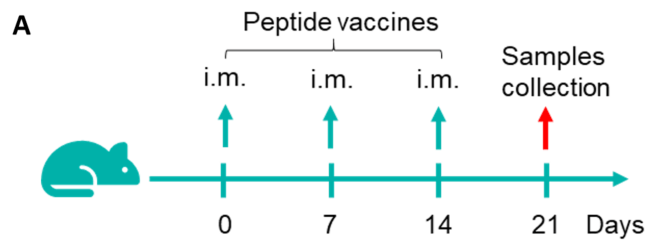
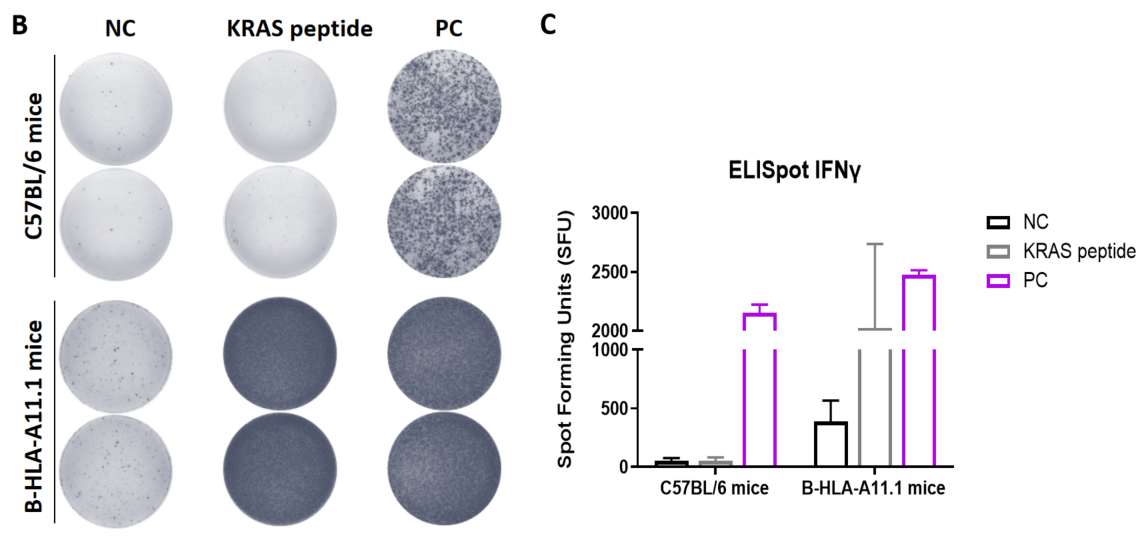
図1. B-HLA-A11.1マウスにおけるペプチドワクチンによる免疫応答(mIFN-γ ELISpotアッセイ) 6〜8週齢の雌B-HLA-A11.1マウスをPBS群とペプチドワクチン群(n = 6)に分け、それぞれの両足筋にPBSまたはワクチンを接種しました。最後の免疫から1週間後、脾細胞を採取し、個別のペプチドまたはターゲット非関連ポリペプチドをネガティブコントロール(NC)として刺激し、mIFN-γ分泌および抗原特異的T細胞を測定しました。(A) 実験計画。(B) 免疫化されたマウスから採取した脾細胞の刺激結果の代表的な結果(ネガティブコントロール、ペプチドワクチン、またはポジティブコントロールで2重複)。(C) 結果のまとめ。値は平均±SEMとして示されています。
NC: ネガティブコントロール PC: ポジティブコントロール
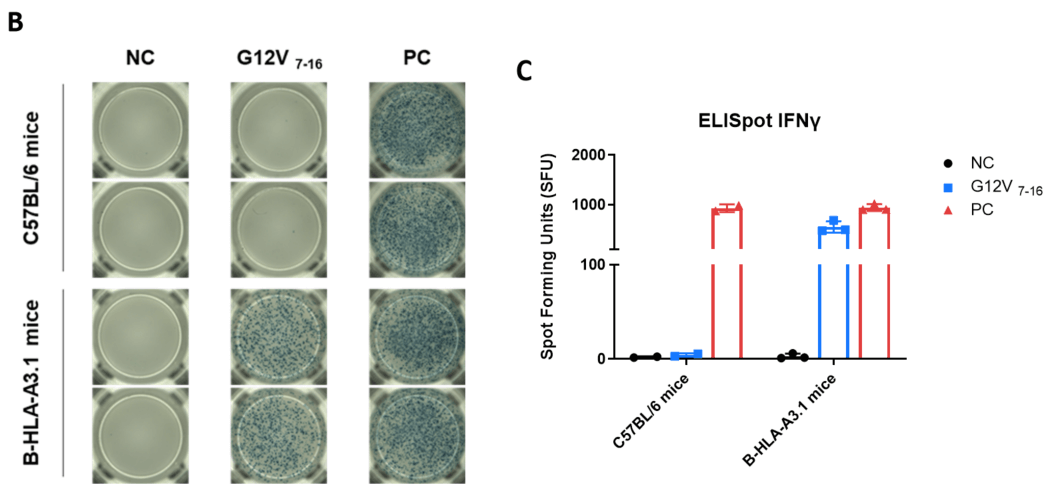
B-HLA-A3.1マウスにおけるペプチドワクチンによる免疫応答(IFN-γ ELISpotアッセイ) 7〜8週齢の雌C57BL/6マウスおよびB-HLA-A3.1マウスを、PBS群およびG12V 7-16群(n = 3)に分け、それぞれの両足筋にPBSまたはワクチンを接種しました。脾細胞を採取し、個別のペプチドまたはターゲット非関連ポリペプチドをネガティブコントロール(NC)として刺激し、IFN-γ分泌を測定しました。(A) 免疫化されたマウスから採取した脾細胞のペプチドワクチンによる刺激の代表的な結果(2重複)。(B) 結果のまとめ。(C) 結果のまとめ。値は平均±SEMとして示されています。