このページで
低分子核酸医薬品(オリゴヌクレオチド医薬品)は、主にアンチセンスオリゴヌクレオチド(ASO)、低分子干渉RNA(siRNA)、低分子活性化RNA(saRNA)、マイクロRNA(miRNA)、アプタマーRNA、CpGオリゴヌクレオチドに分類されます。これらの医薬品は、核酸(RNAまたはDNA)と相互作用することで遺伝子発現を制御し、遺伝子レベルまたは分子レベルで作用します。高い特異性、設計の容易さ、開発サイクルの短縮、幅広い標的範囲、そして長期間にわたる効果といった顕著な利点を有しています。
当社は、低分子核酸医薬品の前臨床試験向けに、カスタマイズされたヒト化マウスを開発しました。これらのモデルは、より安全で効果的な核酸医薬品の開発を促進するために活用されています。
| Efficacy | MOA | Safety |
|
|
|
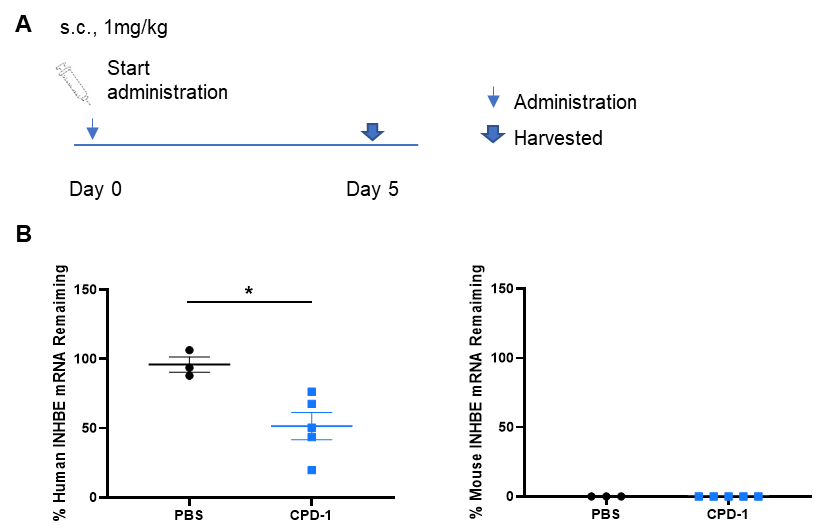
B-hINHBEマウスにおけるヒトINHBEに対する核酸医薬品の阻害効果 B-hINHBEマウスをランダムに2群(雄、9~10週齢)に分け、ヒトINHBE標的核酸医薬(クライアント提供)とPBSをマウスに個別に投与しました。核酸医薬はPBS水溶液で投与しました。5日目に肝臓組織を採取し、qPCRによりヒトINHBE mRNAの発現レベルを測定しました。(A)実験手順の概略図。(B)肝臓におけるヒトINHBE mRNAの発現。CPD-1群のヒトINHBEはコントロール群と比較して、有意に減少しています。値は平均値±標準誤差(SEM)で表されています。
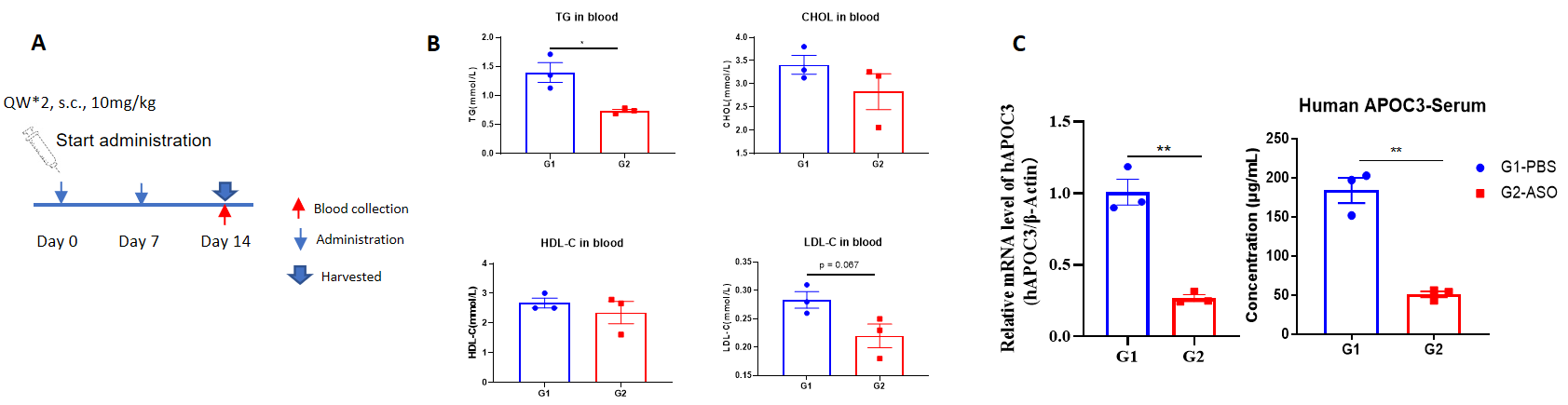
B-hAPOC3マウスにおけるヒトAPOC3に対する核酸医薬品の阻害効果 B-hAPOC3マウスは無作為に2群(n=3/群、6週齢)に分けられ、ヒトAPOC3ターゲットの核酸医薬(特許に基づき合成)とPBSを個別に投与しました。核酸医薬は、PBS水溶液の形で投与されました。すべてのマウスに対する薬剤の投与量は、体重に基づいて計算されました。14日目に肝臓組織を収集して、qPCRでヒトAPOC3 mRNAの発現レベルを測定しました。(A)実験処理の模式図。(B)治療後のB-hAPOC3マウスの血中脂質レベル。コントロール群(G1)と比較して、治療群(G2)はトリグリセリド(TG)が有意に低下しました。(C)肝臓におけるヒトAPOC3 mRNAの発現および血清中のヒトAPOC3タンパク質。治療群(G2)ではヒトAPOC3 mRNAがコントロール群(G1)に比べて有意に低下しており、抑制率は73.4%でした。これにより、B-hAPOC3マウスがヒトAPOC3ターゲット核酸医薬品のin vivo前臨床評価に有効なモデルを提供することが示されました。データは平均値 ± 標準誤差(SEM)で表示されています。
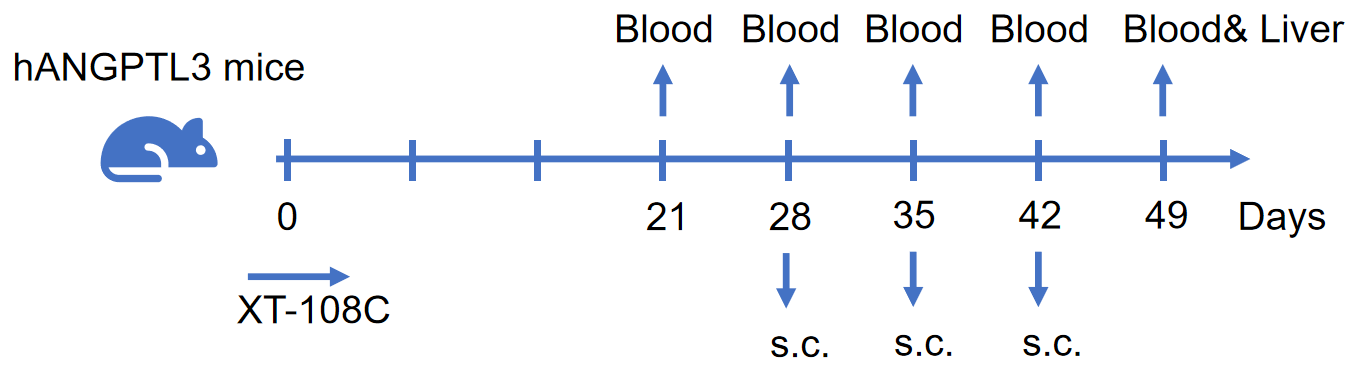
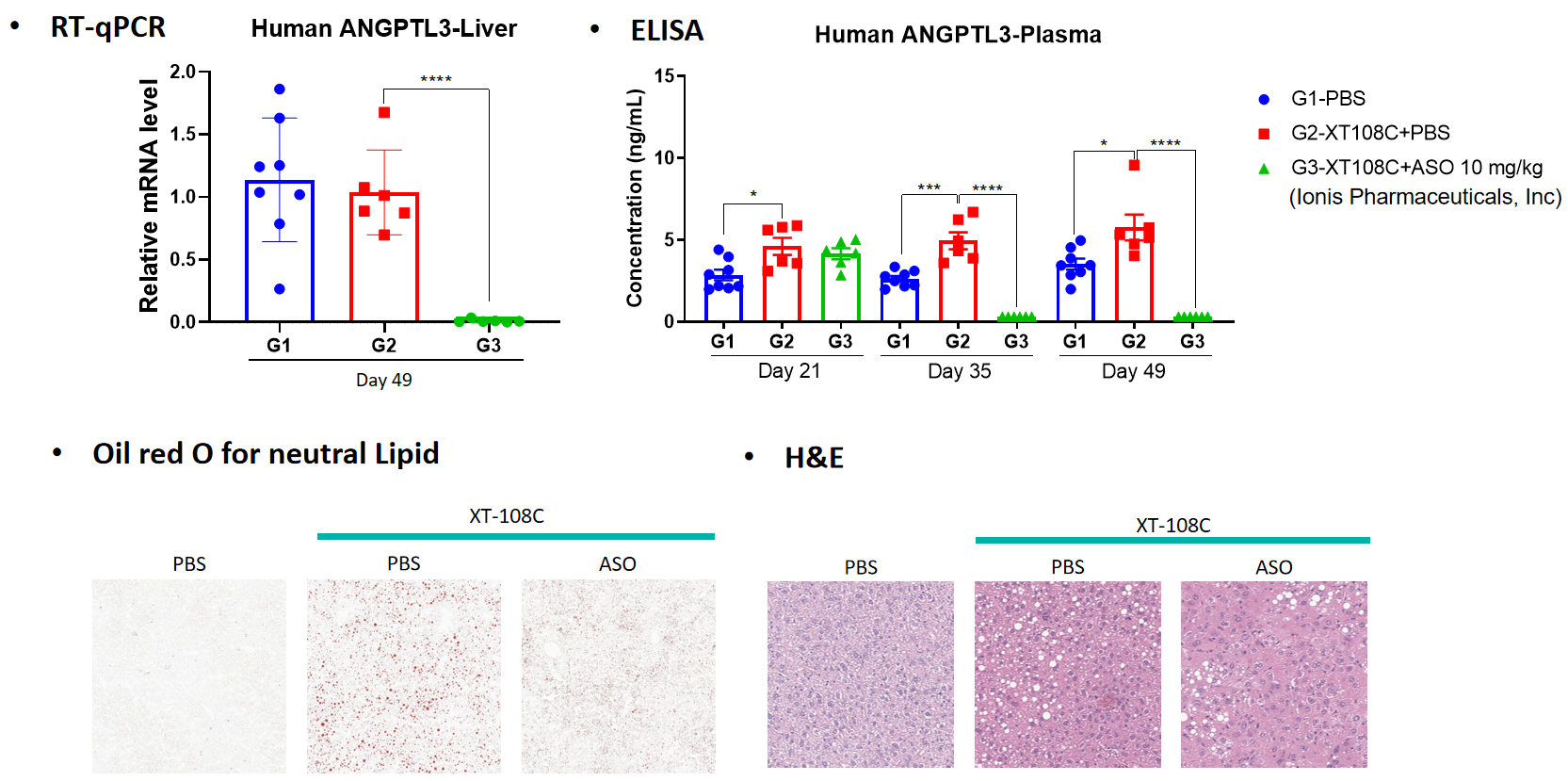
薬力学:
病理分析:
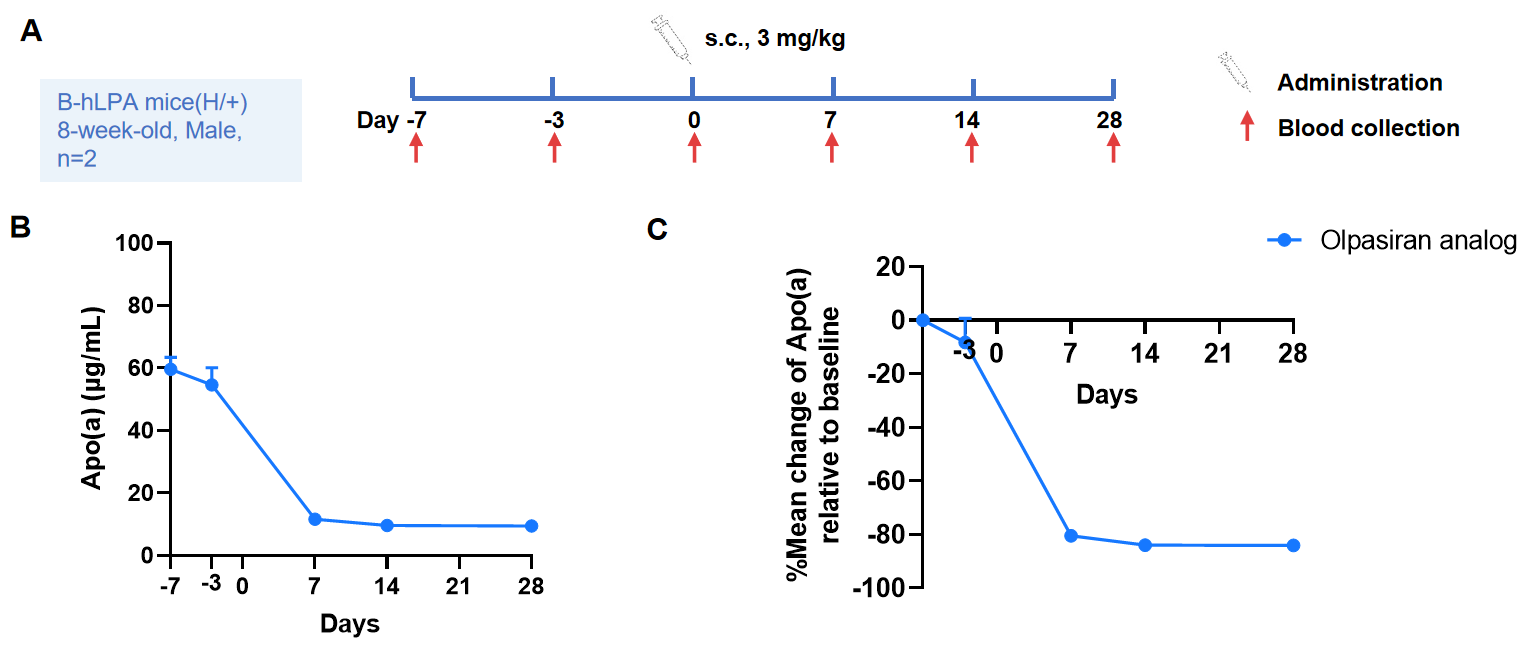
ヘテロ接合性B-hLPAマウスにおけるOlpasiran類似体の血漿apo(a)レベルに与える影響 Olpasiran類似体(クライアント提供)は、リポタンパク質(a)を標的とする二本鎖低分子干渉RNA(siRNA)であり、血漿Lp(a)濃度を強力に低下させます。図に示すように、Olpasiran類似体は、ヘテロ接合性B-hLPAマウス(A)において、単回投与後にアポ(a)濃度を低下させ、ベースラインから最大80%以上の低下を示しました(B)。これらのマウスは、有効性に関する前臨床試験に使用できることを示しています。
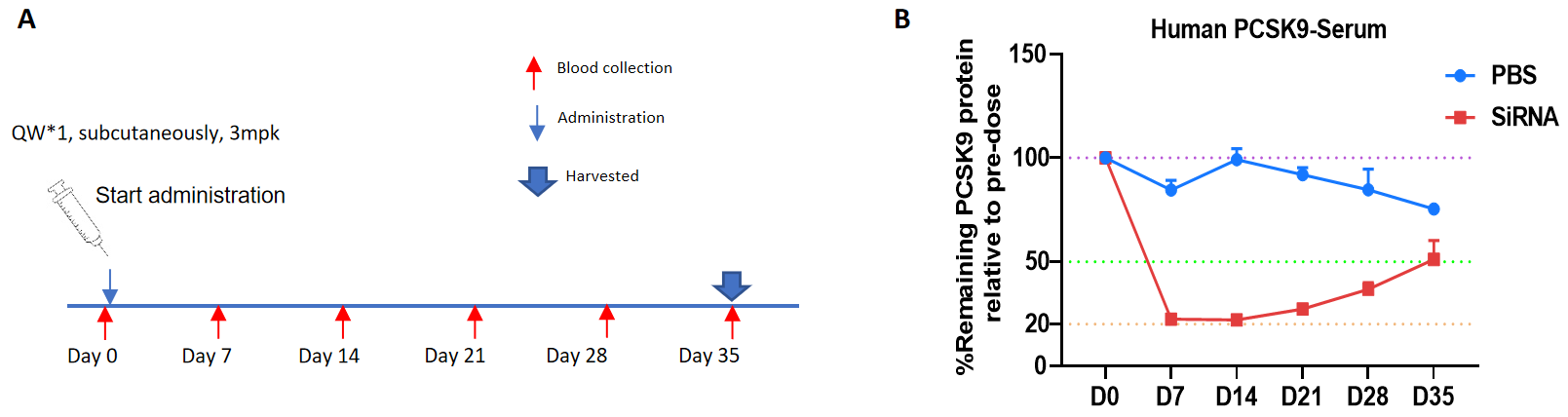
ホモ接合性B-hPCSK9マウスにおけるPCSK9ターゲット核酸医薬品の抑制効果 B-hPCSK9マウスはランダムに2つの群(10週齢、雄)に分けられ、ヒトPCSK9ターゲット核酸医薬であるInclisiran(特許に基づいて合成)とPBSがそれぞれ投与されました。核酸医薬は、PBS水溶液の形で投与されました。(A) 実験プロセスの概略。(B) 投与後7日、14日、21日、28日、35日における血清中のPCSK9蛋白質レベルの変化を、投与前のレベルと比較しました。治療群(G2)のPCSK9レベルはコントロール群(G1)に比べて減少してました。これにより、B-hPCSK9マウスは、PCSK9ターゲット核酸医薬のin vivo前臨床評価用のモデルとして使用できることが示されています。データは平均±SEMとして表されています。