このページで
喘息は、複雑な遺伝的、エピジェネティック、そして環境的要因によって引き起こされる気道の慢性炎症性疾患です。息切れ、喘鳴、咳、過剰な粘液産生などの症状を特徴とし、多くの場合、アレルゲンによって引き起こされます。これらの臨床徴候は、気道過敏性(AHR)、様々な気流閉塞、そして免疫介在性炎症に起因します。細胞レベルでは、気道上皮細胞、好酸球、そして様々なT細胞サブセットが中心的な役割を果たしています。特に、高好酸球性喘息ではTh2細胞が顕著に存在し、IL-4、IL-5、IL-13などのサイトカインを分泌し、特徴的な病理学的変化を引き起こします。
当社は、治療効果の評価に適したオボアルブミン(OVA)、ハウスダストダニ(HDM)、TSLP、Alternaria誘発モデルなど、信頼性の高い検証済みの喘息マウスモデルを提供しています。OVA誘発モデルでは、マウスを腹腔内オボアルブミン注射で感作し、その後、エアロゾル化したOVAを投与します。HDM誘発モデルでは、4週間にわたり反復鼻腔内投与を行います。これらのモデルは、IgEおよび好酸球レベルの上昇、気道粘液の過剰産生、白血球浸潤など、喘息の特徴的な症状を一貫して再現し、ELISAおよび組織学的解析によって検証されています。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
喘息マウスの気管支肺胞洗浄液(BALF)における免疫細胞浸潤
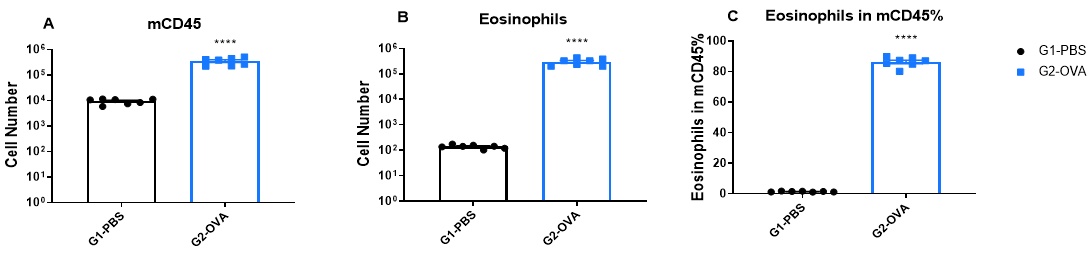
OVA誘発性マウスのBALFにおける免疫細胞数の増加 実験終了時に BALF を採取し、フローサイトメトリーにより CD45+ 細胞数 (A)、好酸球数 (B)、および CD45+ 細胞中の好酸球の割合 (C) を測定しました。
喘息マウス血清におけるIgE誘導
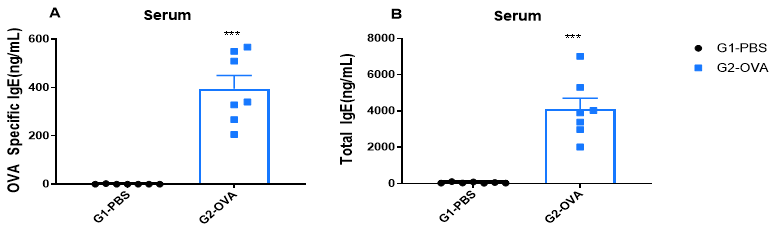
OVA誘発性マウスの血清におけるIgEレベルの増加 実験終了時に血清を分離し、OVA特異的IgE(A)および総IgE(B)の濃度をELISAで測定しました。
喘息マウスの気道組織
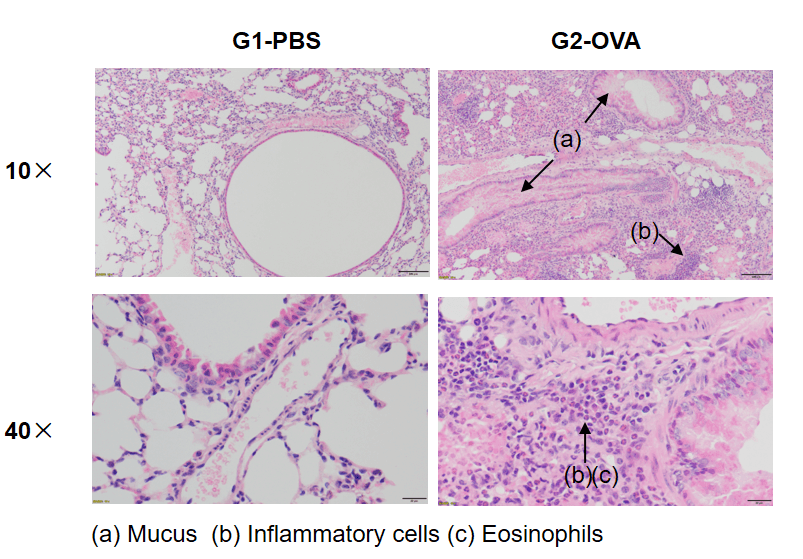
野生型C57BL/6マウスにおけるOVA誘発性喘息 肺組織の H&E 染色では、未治療 (G1) グループと比較して、OVA 治療 (G2) マウスで血管および気管支周囲の炎症 (b) や一部の気管支における粘液 (a) 蓄積など、喘息関連の病理が示されています。
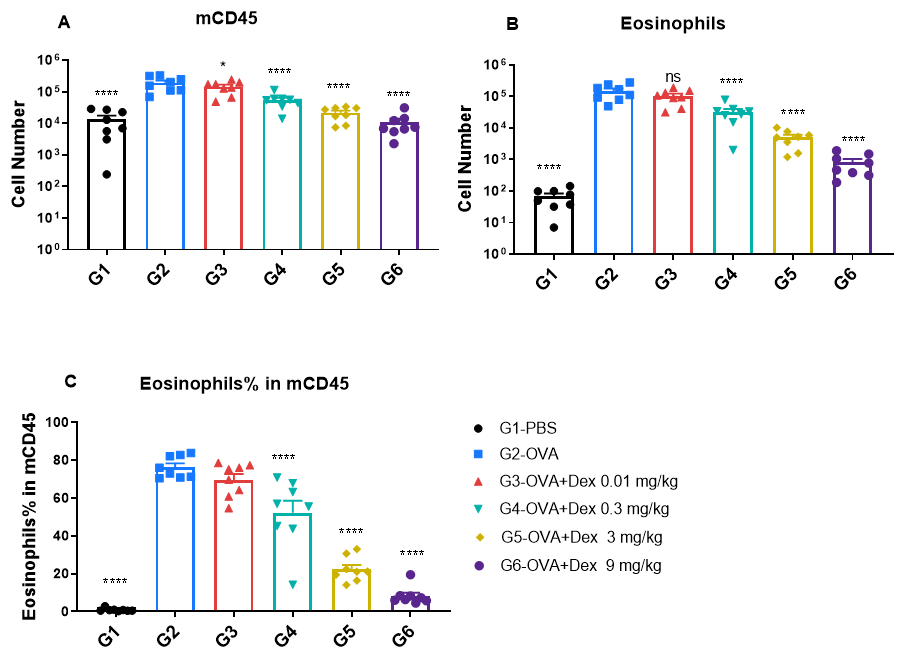
OVA誘発性喘息BALB/cマウスの気管支肺胞洗浄液(BALF)中の免疫細胞の定量 野生型BALB/cマウスにおいて、オボアルブミン(OVA)感作および曝露により喘息を誘発しました。(A)BALF中の総CD45⁺白血球数、(B)BALF中の好酸球数、(C)CD45⁺細胞中の好酸球頻度。OVA誘発喘息群(G2)のマウスは、PBS投与コントロール群(G1)と比較して、総白血球数および好酸球数が有意に増加しており、モデル誘導が成功したことが確認されました。デキサメタゾン投与により、喘息マウスのCD45⁺細胞数および好酸球レベルは、未投与群(G2)と比較して有意に減少しました。
喘息マウスモデルにおける気道組織学
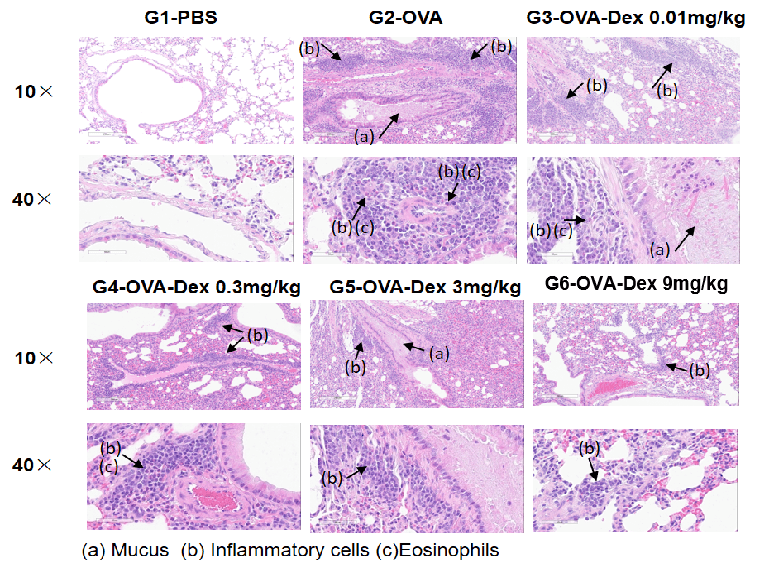
OVA誘発性喘息マウスの肺組織のH&E染色
組織学的分析により、G1コントロール群には肺の炎症が見られませんでした。G2(OVAのみ)群では、血管および気管支周囲の炎症、そして粘液分泌が顕著に増加し、喘息モデルの成功した誘導が確認されました。デキサメタゾン治療(G3)は、炎症細胞の浸潤と粘液の生成を減少させました。これらの結果は、OVA誘導BALB/cマウスモデルが皮質ステロイド免疫抑制効果を評価するためのプラットフォームとして有効であることを示しています。
喘息マウス血清中のIgE誘導

OVA誘発性喘息マウスにおける血清IgEのELISA法による検出
OVA特異的IgE(A)および総IgE(B)の血清レベルは、ELISA法で測定されました。G2(OVAのみ)群は、G1コントロール群と比較してIgEレベルが有意に上昇しており、喘息誘発の成功が確認されました。デキサメタゾン治療は、OVA特異的および総IgEレベルを用量依存的に低下させ、その免疫抑制効果を裏付けました。
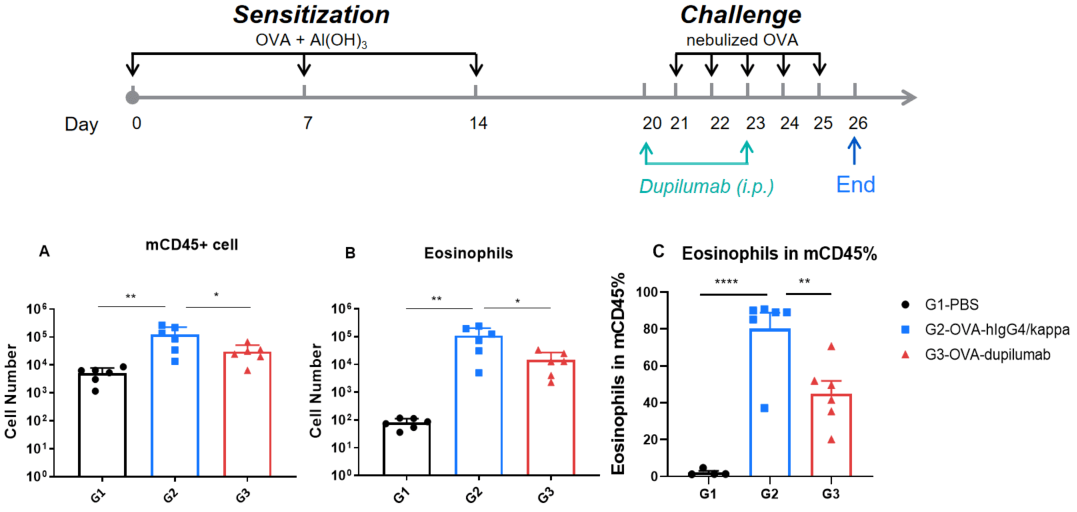
OVA誘発性B-hIL4/hIL4RA喘息マウスのBALF中免疫細胞の定量 B-hIL4/hIL4RAマウスにおいて、OVA感作および曝露により喘息が誘発されました。(A) BALF中のCD45⁺細胞数、(B) 好酸球数、(C) CD45⁺細胞に占める好酸球の割合。G2(OVAのみ)マウスでは、G1コントロール群と比較して、白血球浸潤および好酸球数が有意に増加しており、モデル誘発が成功したことが示されました。Dupilumab(in house)投与により、G2群と比較してCD45⁺細胞および好酸球数が大幅に減少しました。
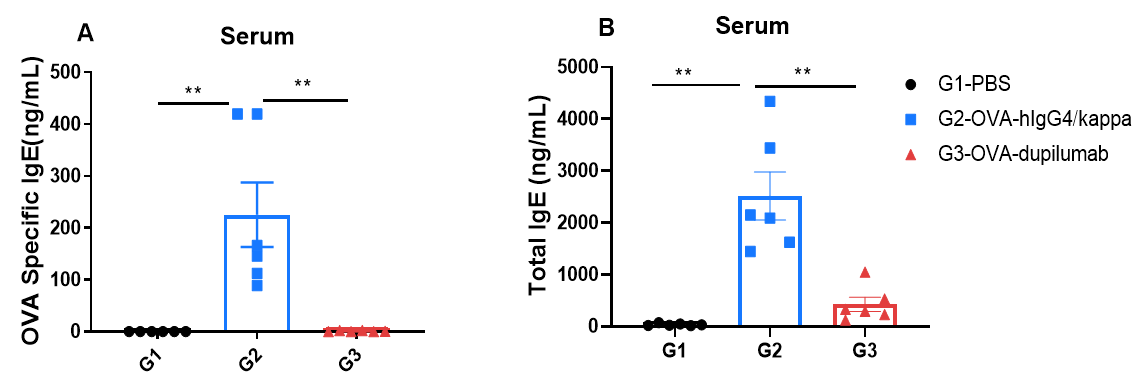
OVA誘発性喘息マウスモデルにおける血清IgEのELISA法による検出 OVA特異的IgE(A)および総IgE(B)の血清レベルは、ELISA法で定量されました。G2(OVAのみ)群は、G1コントロール群と比較してIgEレベルが有意に上昇しており、喘息モデルの誘発が確認されました。Dupilumab(in house)治療は、G2群に対してOVA特異的および総IgEレベルを有意に低下させました。
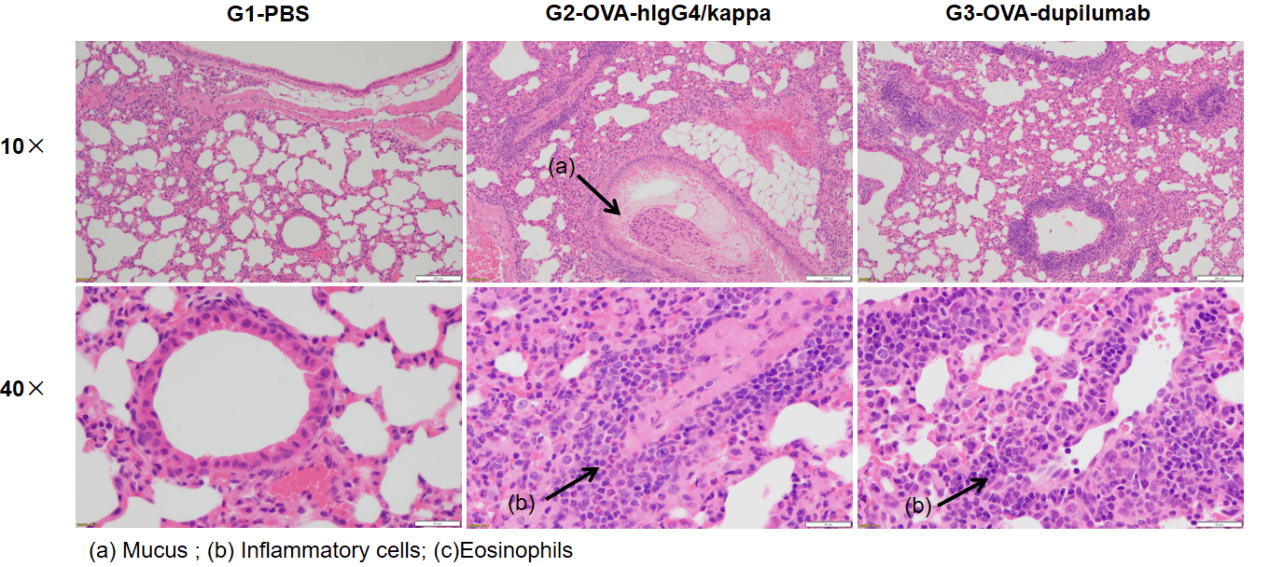
OVA誘発性B-hIL4/hIL4RA喘息マウスモデルにおける肺組織のH&E染色 組織病理学的分析により、G1コントロール群には気道炎症が見られませんでした。G2(OVAのみ)群では、血管および気管支周囲の炎症(b)および粘液分泌(a)の増加が顕著で、喘息モデルの誘発が確認されました。Dupilumab治療を受けたマウス(G3)は、炎症浸潤および粘液生成が減少しました。これらの結果は、OVA誘導B-hIL4/hIL4RAマウスが、抗喘息治療薬の評価に有効であることを示しています。

DSI Buxco FinePointe WBP:非侵襲的呼吸監視
FinePointe全身容積描記(WBP)システムは、覚醒した、拘束されていない動物で精密な呼吸評価を行うことができます。

2〜4匹のマウスでの気道機能テストに40〜60分が必要
B-hIL4/hIL4RA mice (C57BL/6)
B-hIL4/hIL4RA mice (BaIb/c)
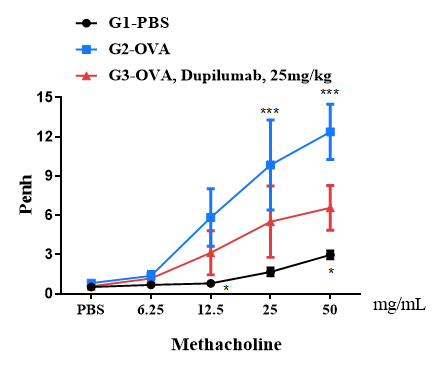
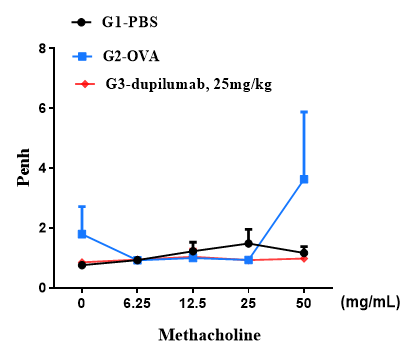
最終的なアレルゲンまたはPBS暴露24時間後に、用量を増加したメタコリン(MCh)を噴霧投与し、全身プレトシオメトリーを用いて各マウスの気道反応を測定しました。y軸はPenhの絶対値を示します。
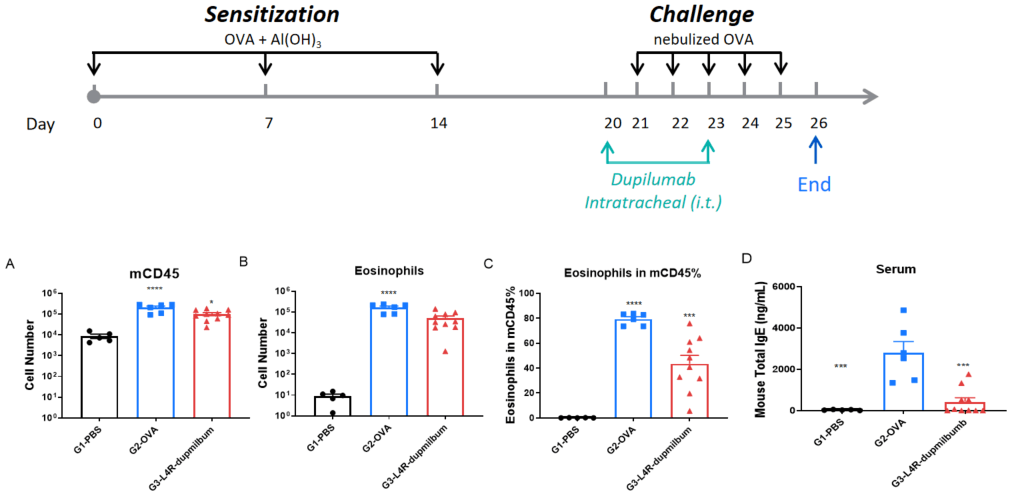
B-hIL4/hIL4RAマウスの気管内(i.t.)投与によるOVA喘息誘発 Dupilumabは、気管内投与で投与されました。パネルには総白血球数(A)、好酸球数(B)、CD45⁺細胞における好酸球の割合(C)、および血清総IgE(D)が示されています。Dupilumabは、気道の炎症およびIgEレベルを有意に低下させました。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
喘息マウスのBALF中の免疫細胞浸潤
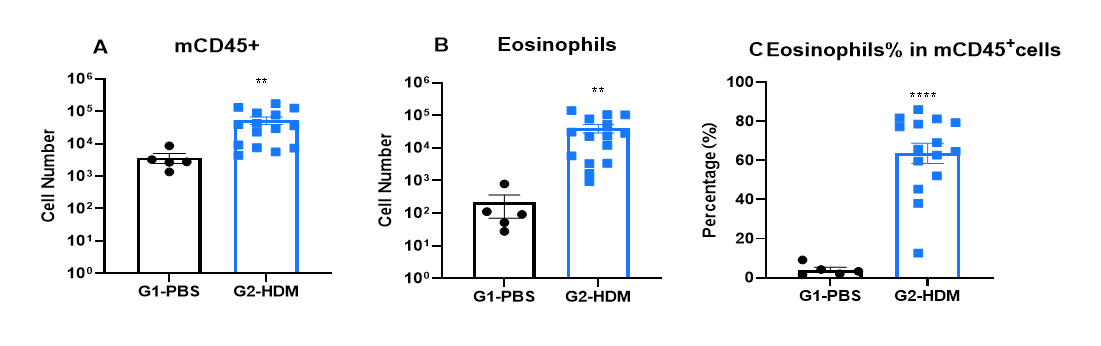
OVA誘発IL4およびIL4受容体ヒト化(B-hIL4/hIL4R)喘息マウスのBALFにおける免疫細胞解析 OVAで感作およびチャレンジを行い、B-hIL4/hIL4RAマウスで喘息を誘発しました。(A)CD45⁺白血球数、(B)好酸球数、(C)BALF中CD45⁺細胞における好酸球の割合を評価しました。G2(OVAのみ処理)マウスはG1コントロール群と比較して、白血球浸潤および好酸球数が有意に増加し、モデルが正常に誘導されたことが確認されました。Dupilumab(in house)治療後、CD45⁺細胞および好酸球レベルは、G2群と比較して有意に減少しました。
喘息マウス血清中のIgE誘導
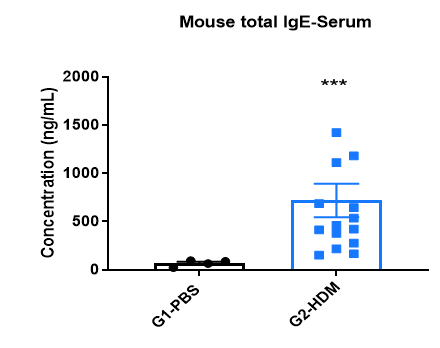
HDM誘発性マウス血清中のIgEレベルの増加 実験終了時に血清を採取し、ELISAで総IgEの濃度を測定しました。
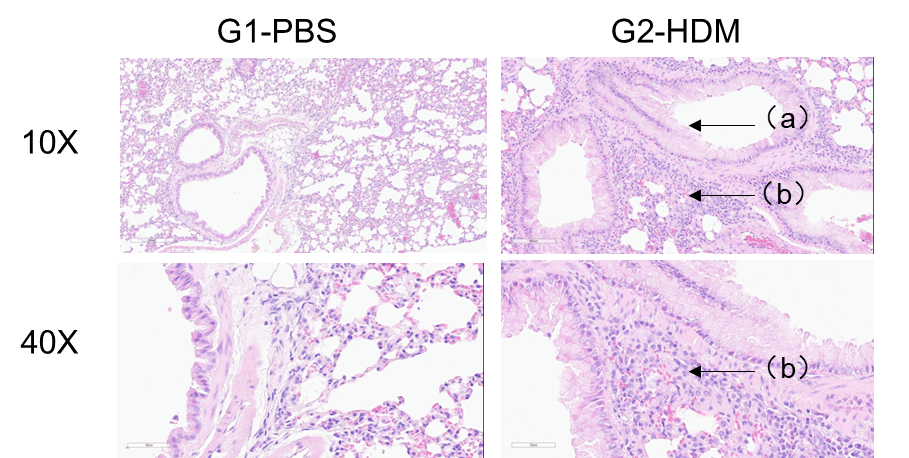
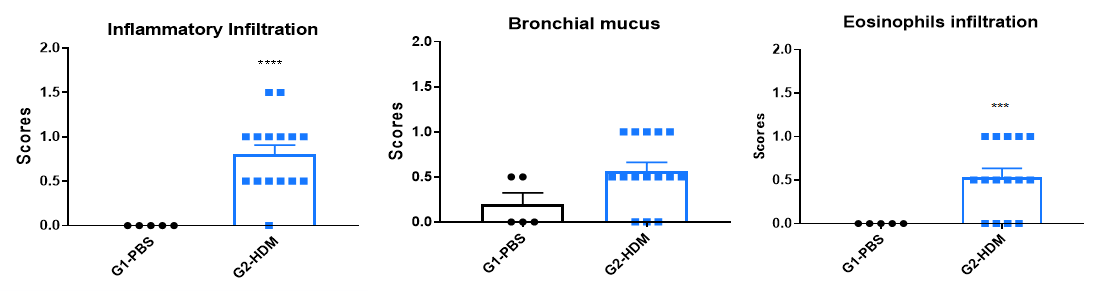
HDM誘発性喘息C57BL/6マウスの肺組織H&E染色 G1コントロール群と比較して、ハウスダストダニ(HDM)を投与したG2マウスは、血管および気管支周囲の炎症細胞浸潤(b)と粘液産生(a)など、特徴的な喘息病態を示しました。これらの結果は、HDMが野生型C57BL/6マウスにおいて、喘息を効果的に誘発することを裏付けています。
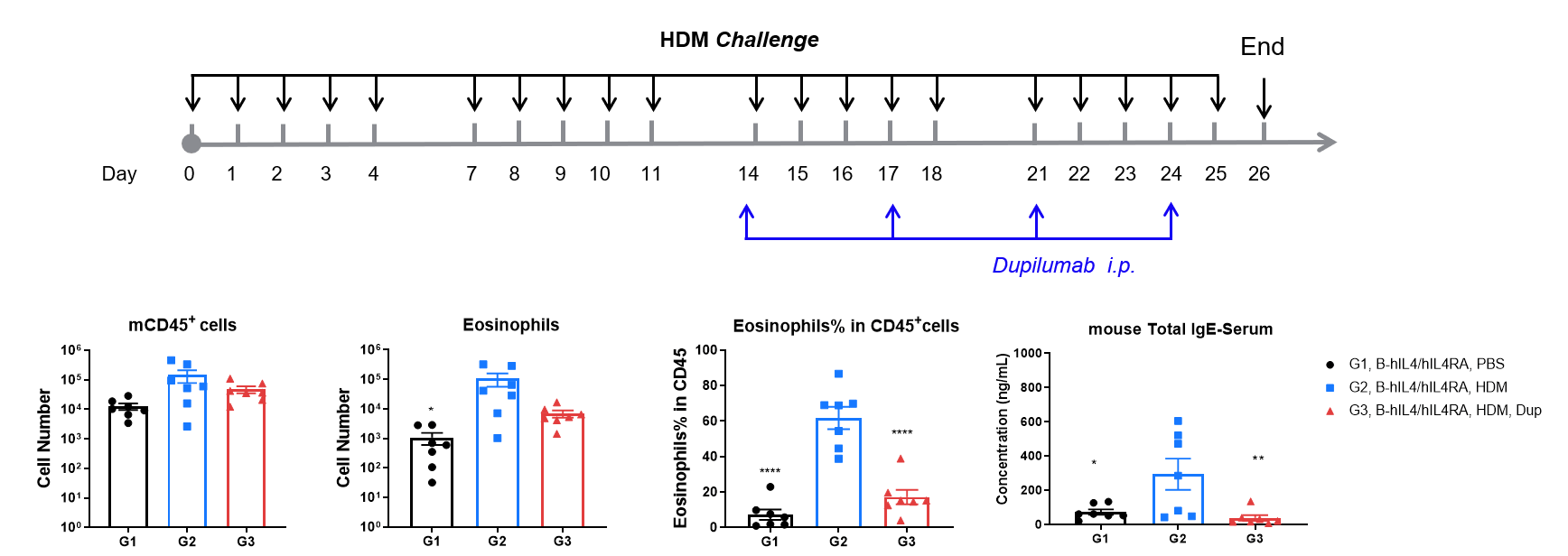
HDM誘導喘息モデルIL-4およびIL-4受容体ヒト化(B-hIL4/hIL4R)マウスにおける抗ヒトIL-4R抗体(Dupilumab)の有効性評価 HDMで感作およびチャレンジした後、G2マウスはG1コントロール群と比較して、BALF中のCD45⁺白血球数、好酸球数および好酸球割合が有意に増加し、喘息モデルが正常に誘発されたことを示しています。Dupilumab(25 mg/kg)治療後、CD45⁺細胞および好酸球数は有意に減少しました。最終時点で、ELISAによって測定された血清総IgEレベルは、G2群で上昇しましたが、Dupilumab投与後に有意に減少しました。これにより、IL-4Rブロックの治療効果が確認されました。
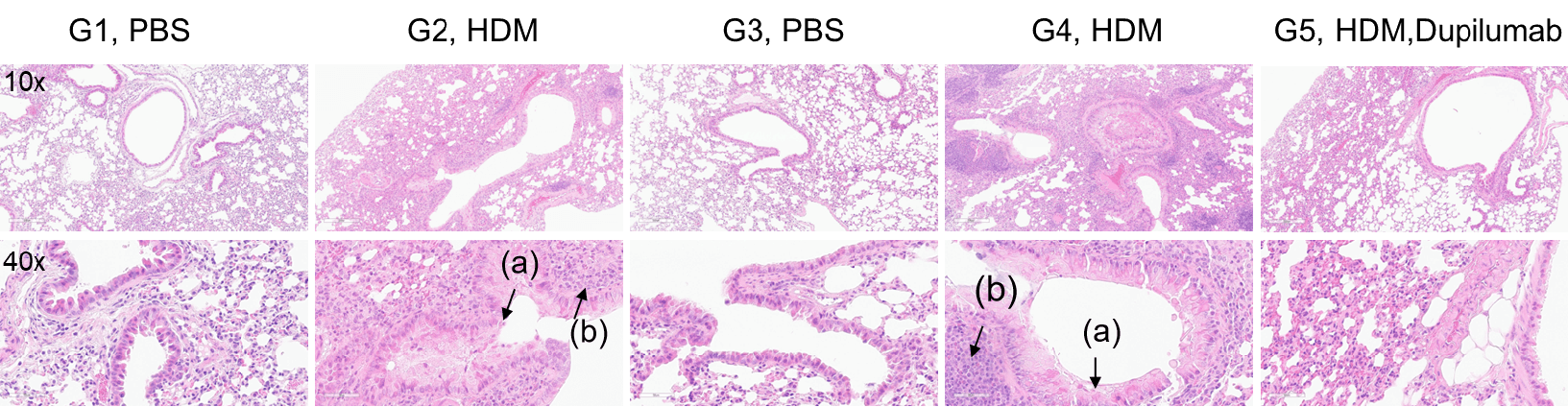
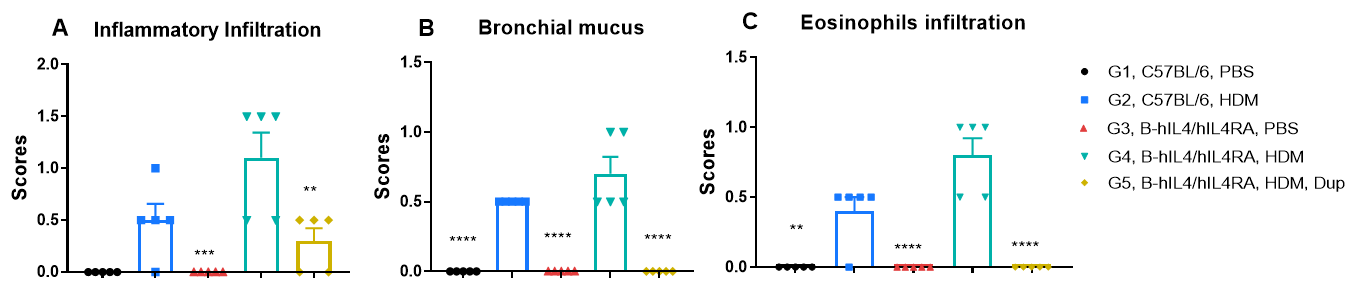
HDM誘発性喘息マウスの肺組織H&E染色 未治療のコントロール群であるG1(C57BL/6)およびG3(B-hIL4/hIL4RA)マウスと比較して、ハウスダストダニ(HDM)を投与したG2(C57BL/6)およびG4(B-hIL4/hIL4RA)マウスは、気管支周囲および血管周囲の混合炎症細胞浸潤(b)および気管支粘液蓄積(a)など、典型的な喘息病態を示しました。Dupilumab投与は、これらの病理学的特徴を有意に軽減し、HDM誘発性アレルギー性喘息モデルにおける抗IL-4R阻害薬の治療効果を示しました。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune cell infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
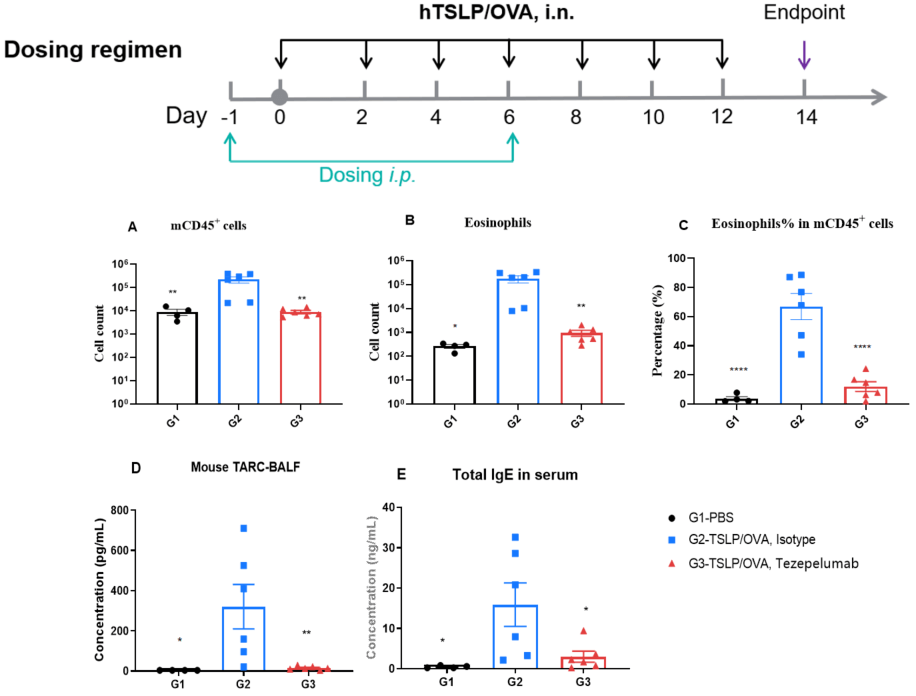
TSLPおよびTSLP受容体ヒト化(B-hTSLP/hTSLPR)マウスのhTSLP/OVA誘発喘息モデルにおける抗ヒトTSLP抗体(Tezepelumab)の有効性 OVA/TSLPで感作されたB-hTSLP/hTSLPRマウスに喘息が誘発され、G2はG1コントロール群と比較してBALF中のCD45⁺白血球数、好酸球数および好酸球割合が有意に増加しました。Tezepelumab(in house)の治療により、CD45⁺細胞および好酸球が顕著に減少しました。最終的に、ELISAで測定したBALF中のTARCレベルおよび血清総IgE濃度は、G2で有意に増加し、Tezepelumab投与後に減少しました。これにより、このアレルギー喘息モデルにおけるTSLPブロックの治療効果が確認されました。
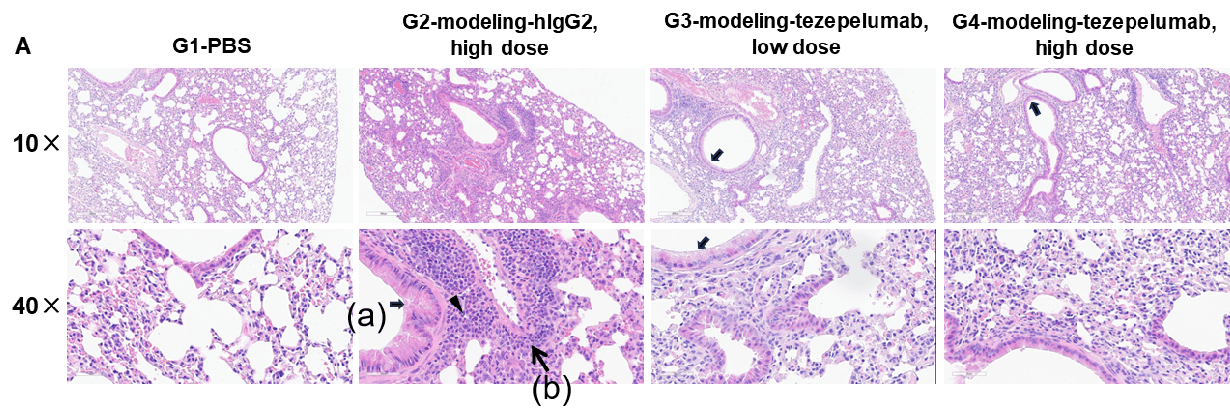
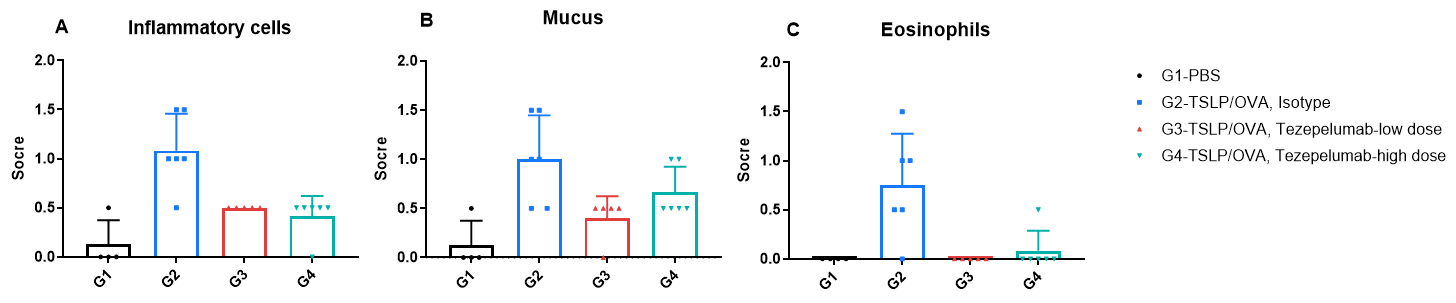
TSLPおよびTSLP受容体ヒト化(B-TSLP/TSLPR)マウスのTSLP/OVA誘発喘息モデルにおける肺組織のH&E染色および組織病理学的スコアリング G1(PBS投与コントロール群)と比較して、G2(TSLP/OVA + アイソタイプ)マウスは、血管および気管支周囲の混合炎症細胞浸潤(b)および気管支における粘液蓄積(a)など、典型的な喘息病態を示しました。G3(低用量)およびG4(高用量)におけるTezepelumab投与は、用量依存的に気道炎症および粘液分泌を減少させました。G2では炎症細胞浸潤、粘液産生、および好酸球数の増加が観察されましたが、これらはすべて抗TSLP療法によって軽減され、このアレルギー性喘息モデルにおけるTezepelumabの有効性を裏付けています