このページで
抗体薬物複合体(ADC)は、新規バイオ医薬品の一つであり、特定の腫瘍抗原を認識するモノクローナル抗体、強力な細胞傷害性薬剤(ペイロード)、そしてペイロードと抗体を連結するリンカーから構成され、モノクローナル抗体の特異性を利用して、強力な細胞傷害性薬剤を抗原発現腫瘍細胞に選択的に送達することを目指しています。近年、ADCは将来の疾患治療における重要な手段として注目されており、その世界的な普及が進んでいます。
強力なin vivoおよびin vitroプラットフォームに基づき、当社はADCおよび他の抗癌療法との併用戦略の前臨床研究のための、最先端のADC評価プラットフォームを確立しました。
当社のフローサイトメトリーおよび細胞ベースのプラットフォームは、抗体親和性および結合、内部化プロセス、ペイロードの効力(アポトーシスおよび細胞周期)、および抗体断片の効力(ADCC、CDC、ADCP)の評価を含む、迅速で信頼性が高く再現性のあるin vitro研究をサポートします。in vivo ADC評価のために、当社の経験豊富なチームと広範なCDXモデルが、ADCおよび併用治療の効率的な有効性評価を促進します。さらに、毒性研究に使用できるTAAターゲットヒト化マウスモデルや、ADC開発に特化した抗原特異的過剰発現またはノックイン細胞株のカスタマイズも提供しています。
| Projects | Experiments | Methods | ||
| Binding Assays | Target Antigen Binding (Same Family) | Binding activity detection | SPR/BLI | OK |
| Target Antigen Cross-Binding(Human, Mouse, Monkey) | Binding activity detection | SPR/BLI | OK | |
| FcRn Binding | Binding activity detection | SPR/BLI | OK | |
| FcγR Receptor Family Binding | Binding activity detection | SPR/BLI | OK | |
| C1q Binding | Binding activity detection | ELISA | OK | |
| Functional Studies (in vitro) |
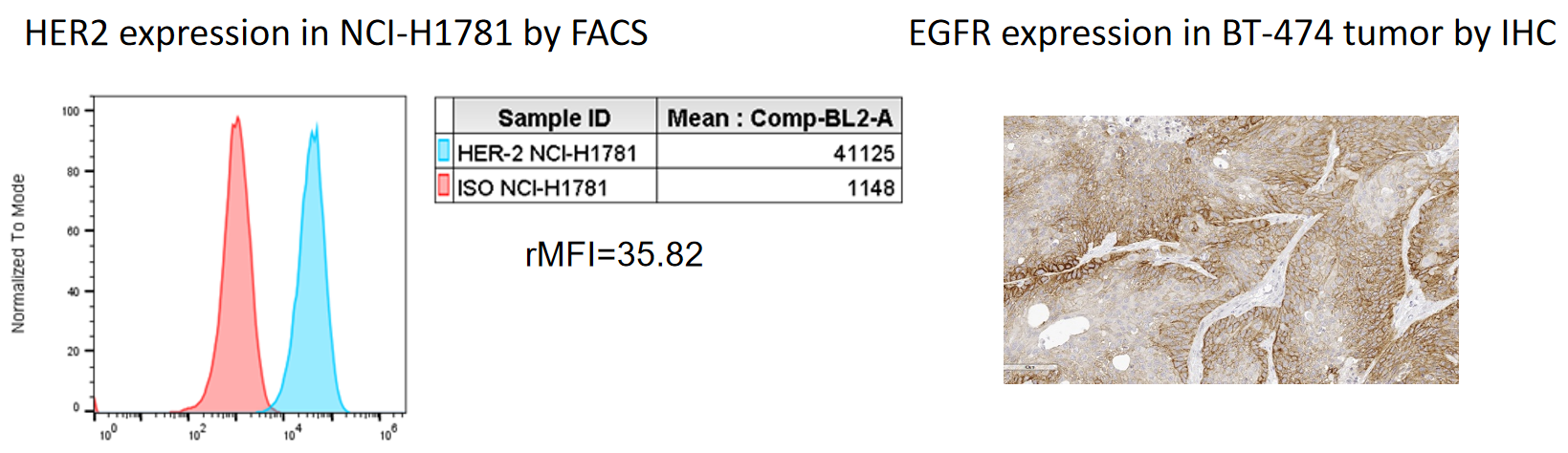
Cell screening | Protein expression detection | Flow cytometry, IHC | OK |
| Antibody binding | Antibody concentration titration | Flow cytometry | OK | |
| Cytotoxicity | Proliferation inhibition | CTG, Prestoblue, IncuCyte | OK | |
| Bystander effect | Flow cytometry, Incucyte | OK | ||
| Mechanistic research | Antibody endocytosis | Flow cytometry, Incucyte, Confocal | OK | |
| Apoptosis | Flow cytometry, Incucyte | OK | ||
| Cell Cycle | Flow cytometry | OK | ||
| ADCC, CDC, ADCP | Flow cytometry, LDH, CTG, Prestoblue | OK | ||
| Lysosome Co-localization | confocal | OK | ||
| Ligand Blocking | Flow cytometry | OK | ||
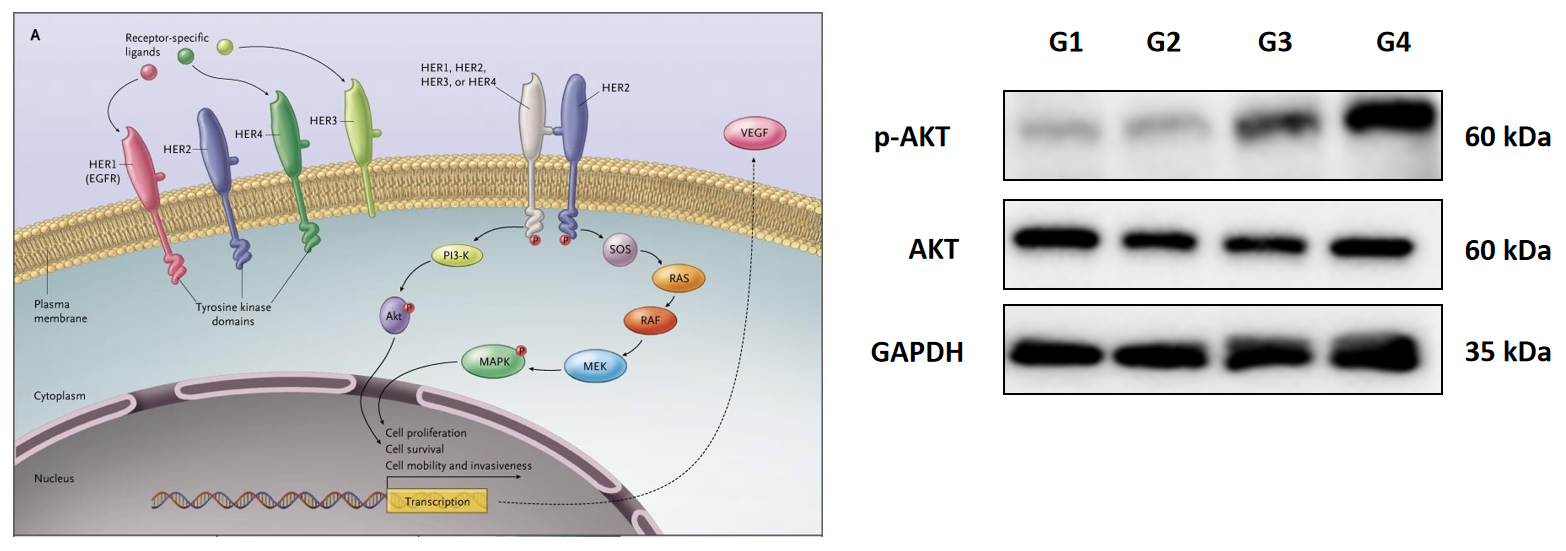
| Signaling pathways | Western Blot, MSD … | OK | ||
| Pharmacokinetics (ex vivo) |
Stability | Test stability of ADC in plasma (Human, Mouse, Monkey) | LC-MS | OK |
| PK Profile | Serum concentration monitoring | ELISA, MSD | OK | |
| Efficacy Studies (in vivo) |
Anti-tumor efficacy | CDX model | Tumor volume | OK |
| PDX model | Tumor volume | OK | ||
| Orthotopic model | Bioluminescence | OK | ||
| Bystander effect | Bioluminescence | OK | ||
| Tissue distribution | ELISA, MSD | Developing |
腫瘍細胞株におけるTrop2発現の絶対定量
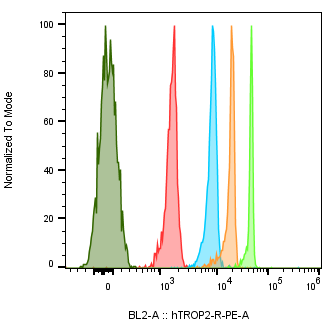
| Cell Line Name | Trop2 Expression level (/cell) |
| NCI-N87 | 667,835 |
| A431 | 3,816,803 |
| MCF-7 | 445,552 |
| NCI-H292 | 1,375,075 |
| NCI-H520 | 822 |
| NCI-H1975 | 401,381 |
| HCC827 | 821,464 |
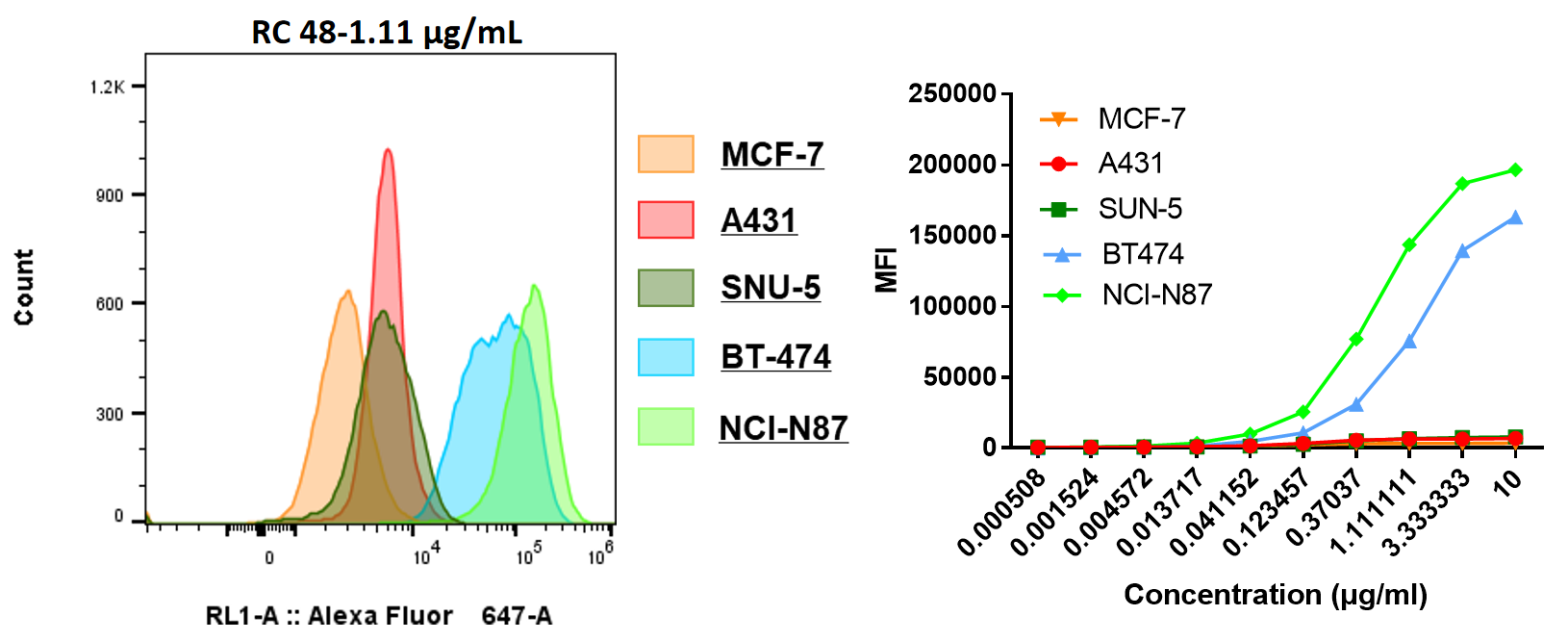
| EC50 (μg/mL) | |
| NCI-N87 | 0.511 |
| MCF-7 | - |
| BT474 | 1.042 |
| SNU-5 | - |
| A431 | - |
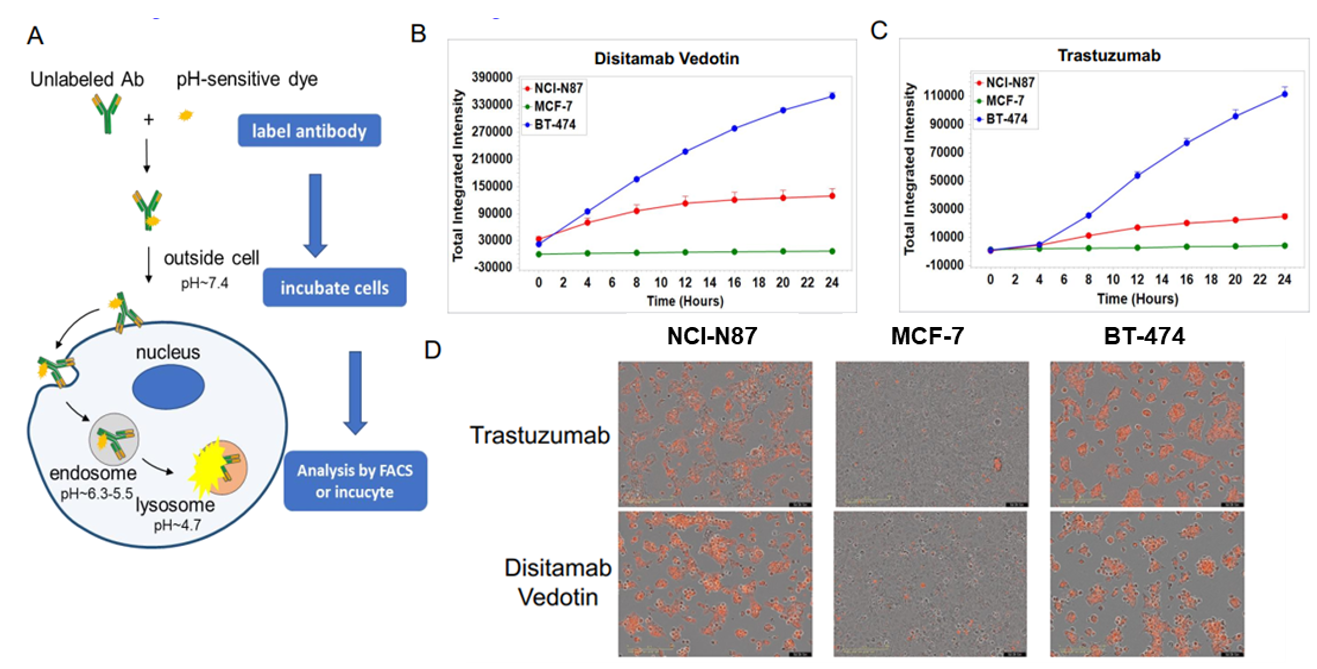
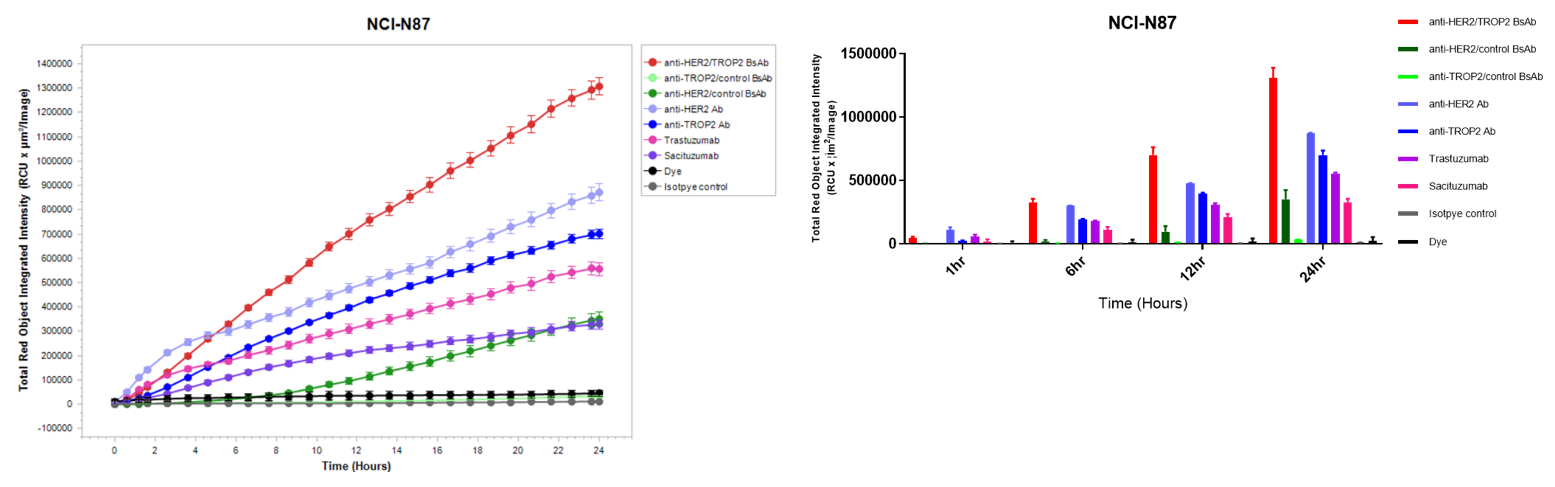
Disitamab Vedotinおよびtrastuzumabのin vitro 内因アッセイ A: 抗体内因アッセイの模式図。NCI-N87、MCF-7、BT-474細胞をpH感受性色素標識のDisitamab Vedotin(RC-48)またはtrastuzumabと24時間インキュベートし、Incucyteで継続的に観察しました。B-C: 縦軸は細胞内抗体の量を示します。D: 写真中のオレンジ色の信号は内因した抗体を示しています。Disitamab Vedotin(RC-48)およびtrastuzumabは、両方とも NCI-N87 細胞と BT-474 細胞に時間依存的に内在化されましたが、MCF-7 細胞には内在化されませんでした。
| gene_name | FPKM NCI_N87 |
| HER2 | 1444 |
| TROP2 | 761 |
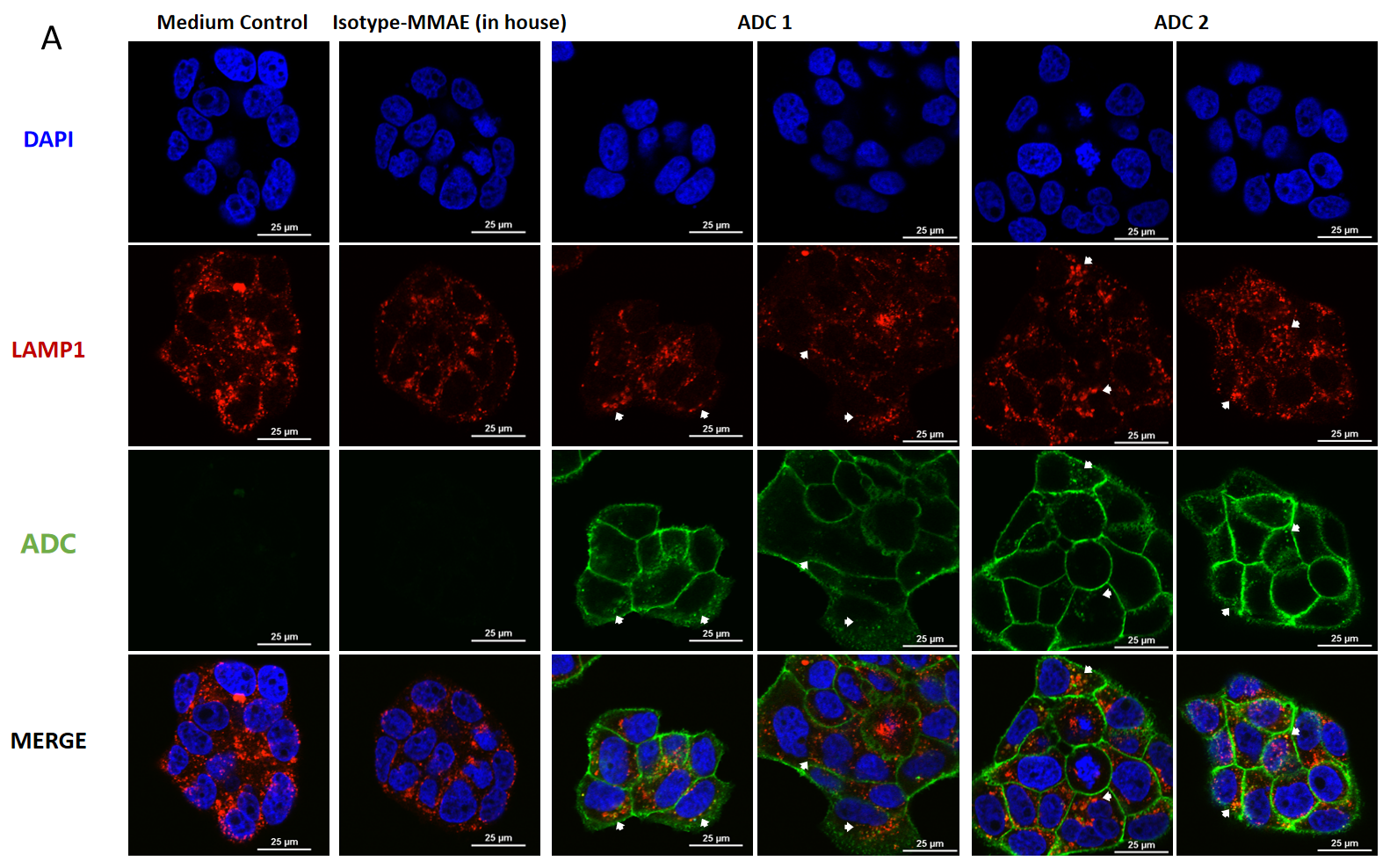
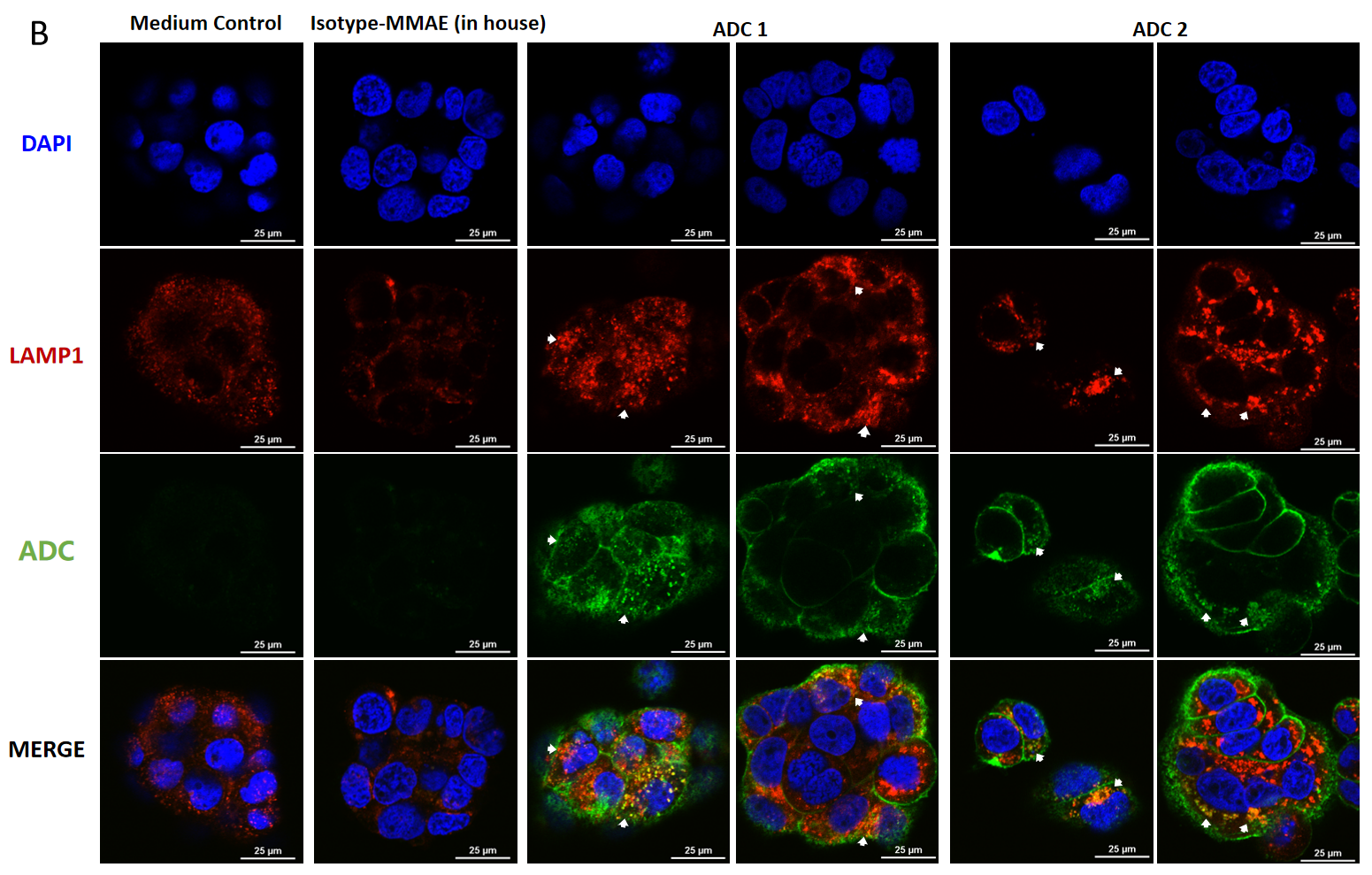
BT474(Her2+およびTrop2+)細胞の共焦点顕微鏡画像、MMAE結合ADCの内因、およびリソソーム転送の示例
BT474細胞にはADCを投与し(A)4時間および(B)24時間後(各ADC10 μg/mL)、FITC標識のヤギ抗ヒトIgG抗体(緑色)で染色しました。リソソームはLAMP1マウスモノクローナル抗体およびCy3標識のヤギ抗マウスIgG二次抗体(赤色)で染色し、細胞核はDAPI(青色)で染色しました。スケールバーは25μm。
| MDA-MB-468: BT474 | ||
| 0:1 | 1:0 | 1:1 |
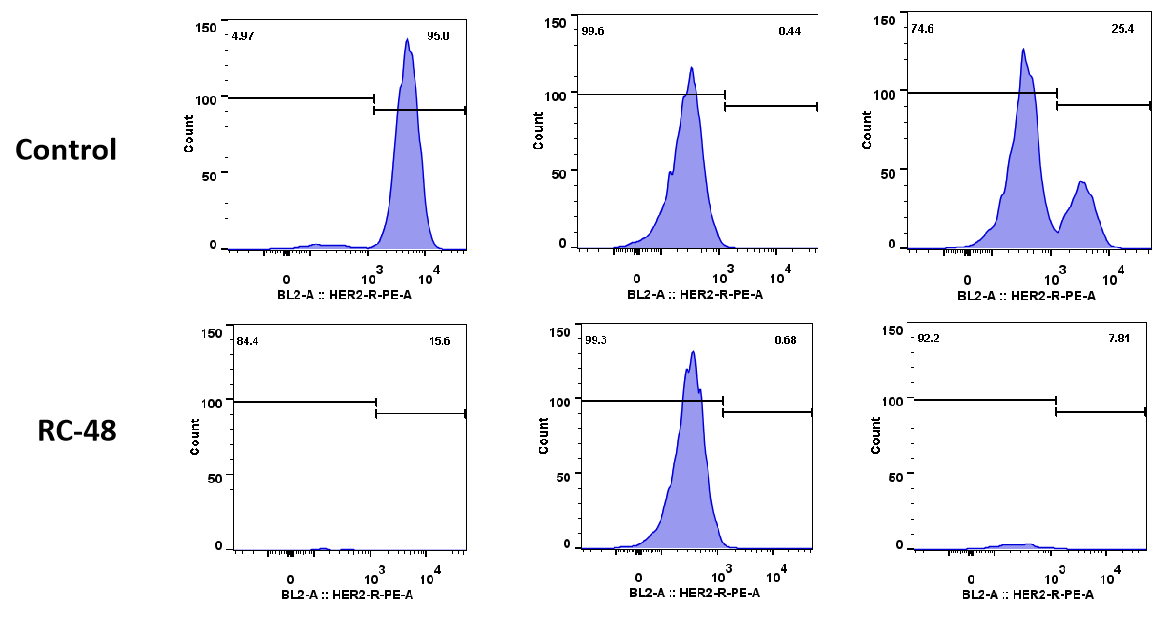
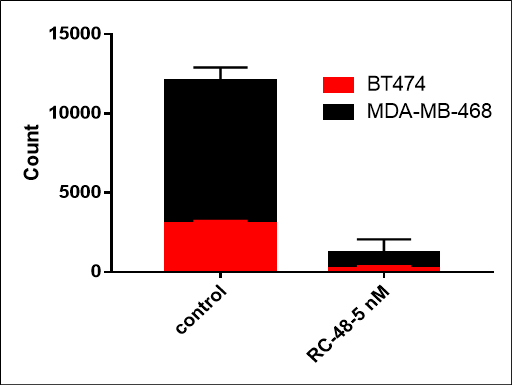
MDA-MB-468細胞(Her2-)およびBT474(Her2+)細胞を異なる割合(それぞれ0:1、1:0、1:1)で一晩共培養しました。RC48またはビークルで5日間処理した後、細胞数およびHER2陽性とHER2陰性細胞の比率をフローサイトメトリーで解析しました。RC48は、BT474細胞に対して優れた腫瘍殺傷作用を示し、MDA-MB-468細胞に対してほとんど細胞毒性を示しませんでした。RC48は、BT474細胞と共培養することでMDA-MB-468細胞も殺傷できることが確認できました。
| B-CAG-luc-GFP KI, EGFR KO BxPC-3: BxPC-3 | ||
| 1:1 | 1:0 | 0:1 |
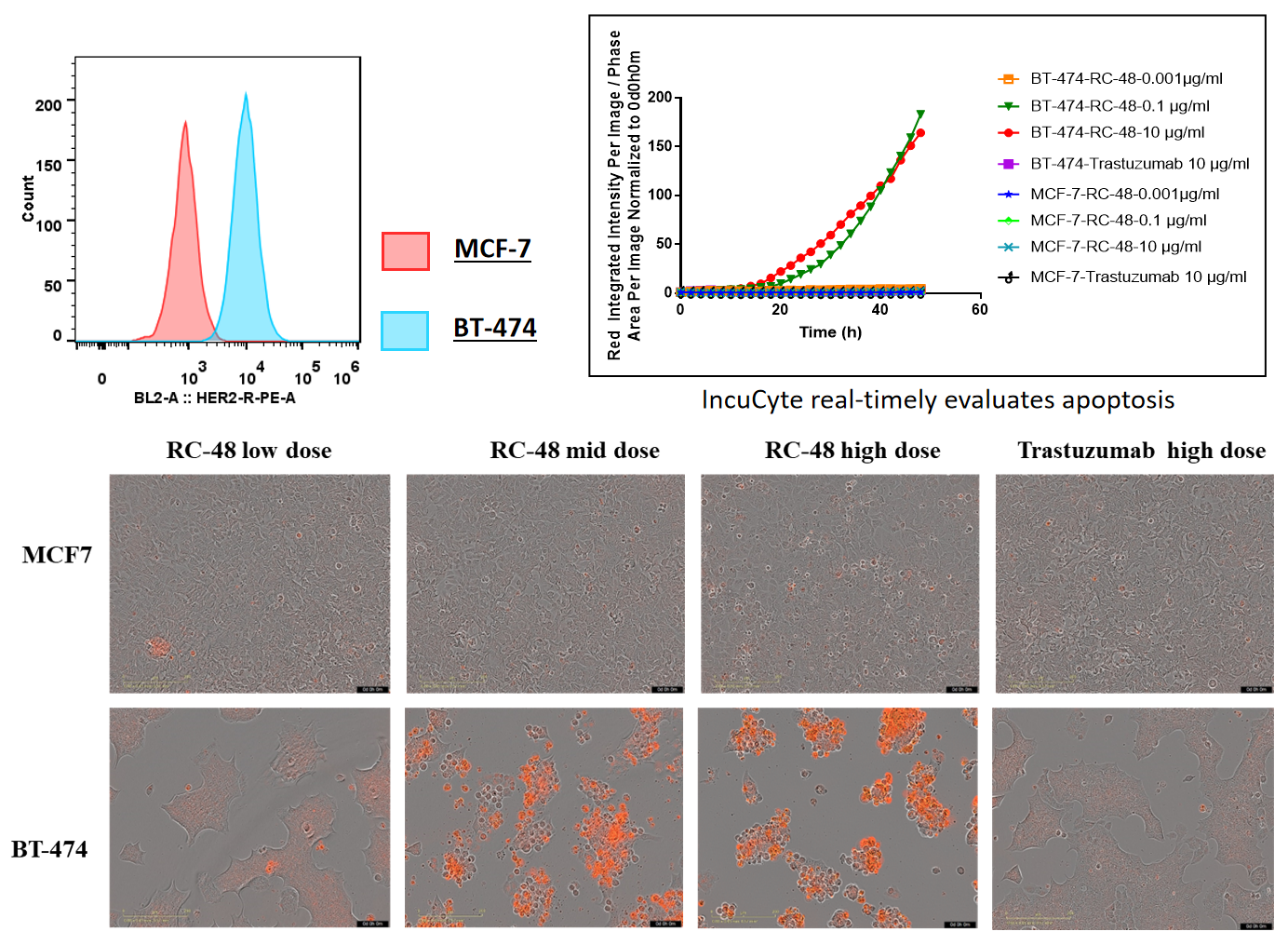
BT-474(Her2+)およびMCF7(Her2-)細胞を、異なる濃度のtrastuzumabまたはRC48で72時間処理しました。アポトーシスはSartorius IncuCyte Caspase-3/7赤アポトーシス試薬で検出されました。赤色の信号は活性化されたカスパーゼ3/7を示します。RC48(中・高用量)は、BT-474のアポトーシスを著しく促進しましたが、trastuzumabでは見られませんでした。同様に、MCF7細胞では、処理後アポトーシスは観察されませんでした。
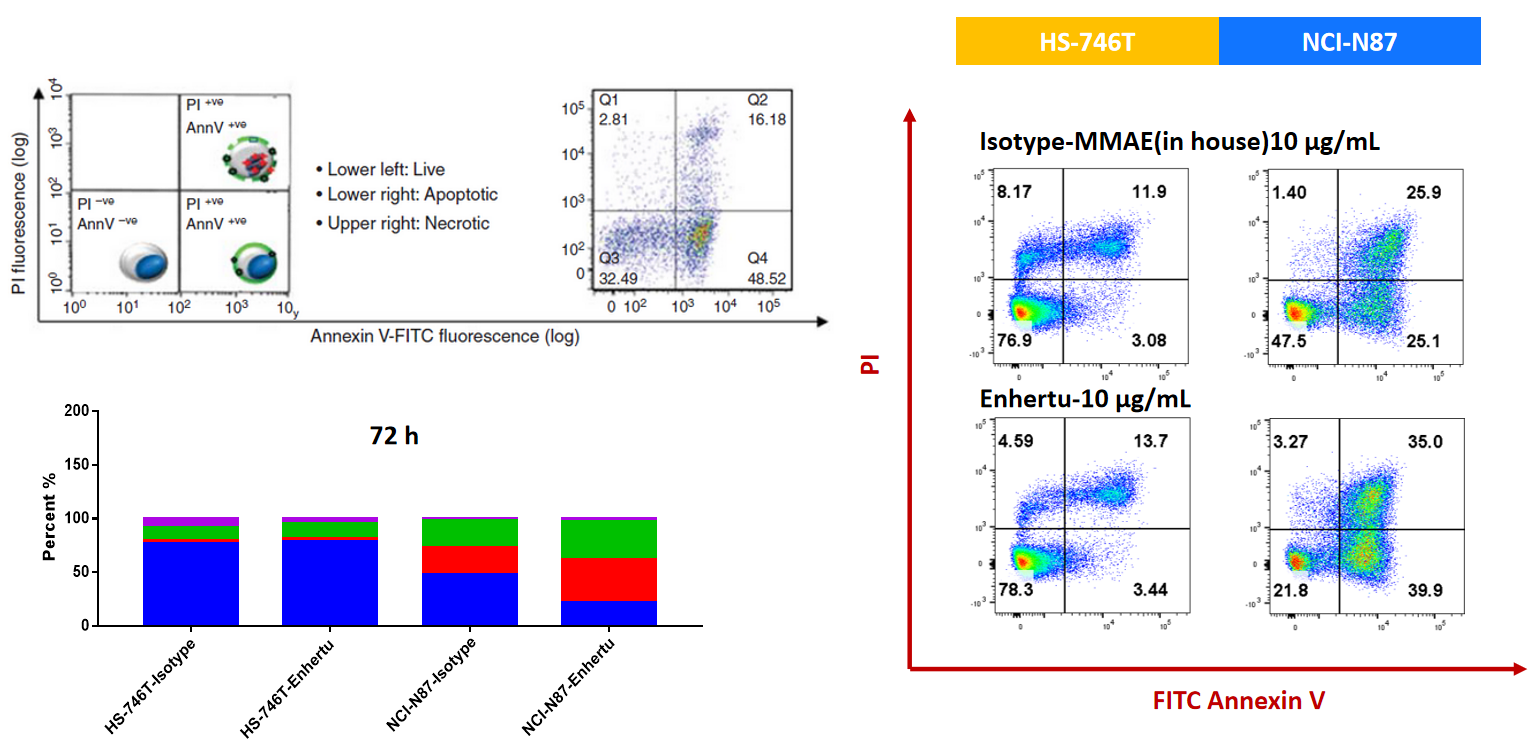
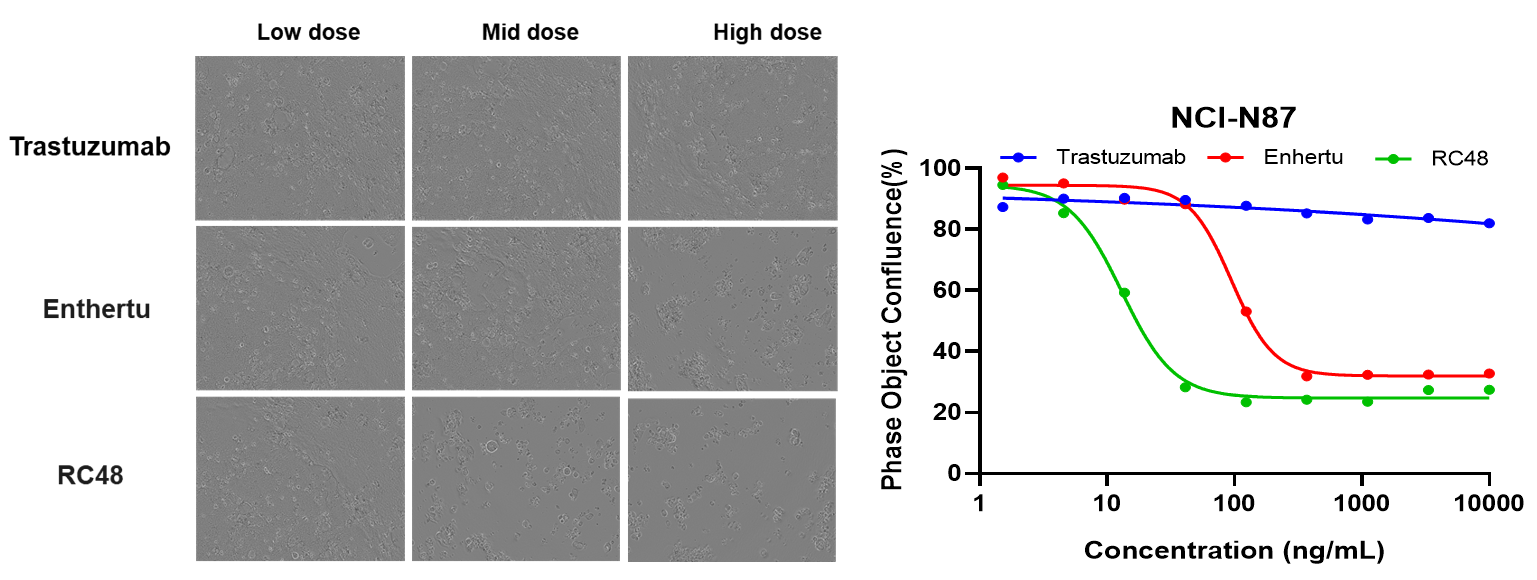
NCI-N87(Her2+)およびHS-746T(Her2-)細胞を、ISO-MMAEおよびEnthertuで72時間処理しました。アポトーシスは、Annexin V/PIキットとフローサイトメトリーで検出されました。Her2高発現のNCI-N87において、Enthertuは有意にアポトーシスを誘導しました。
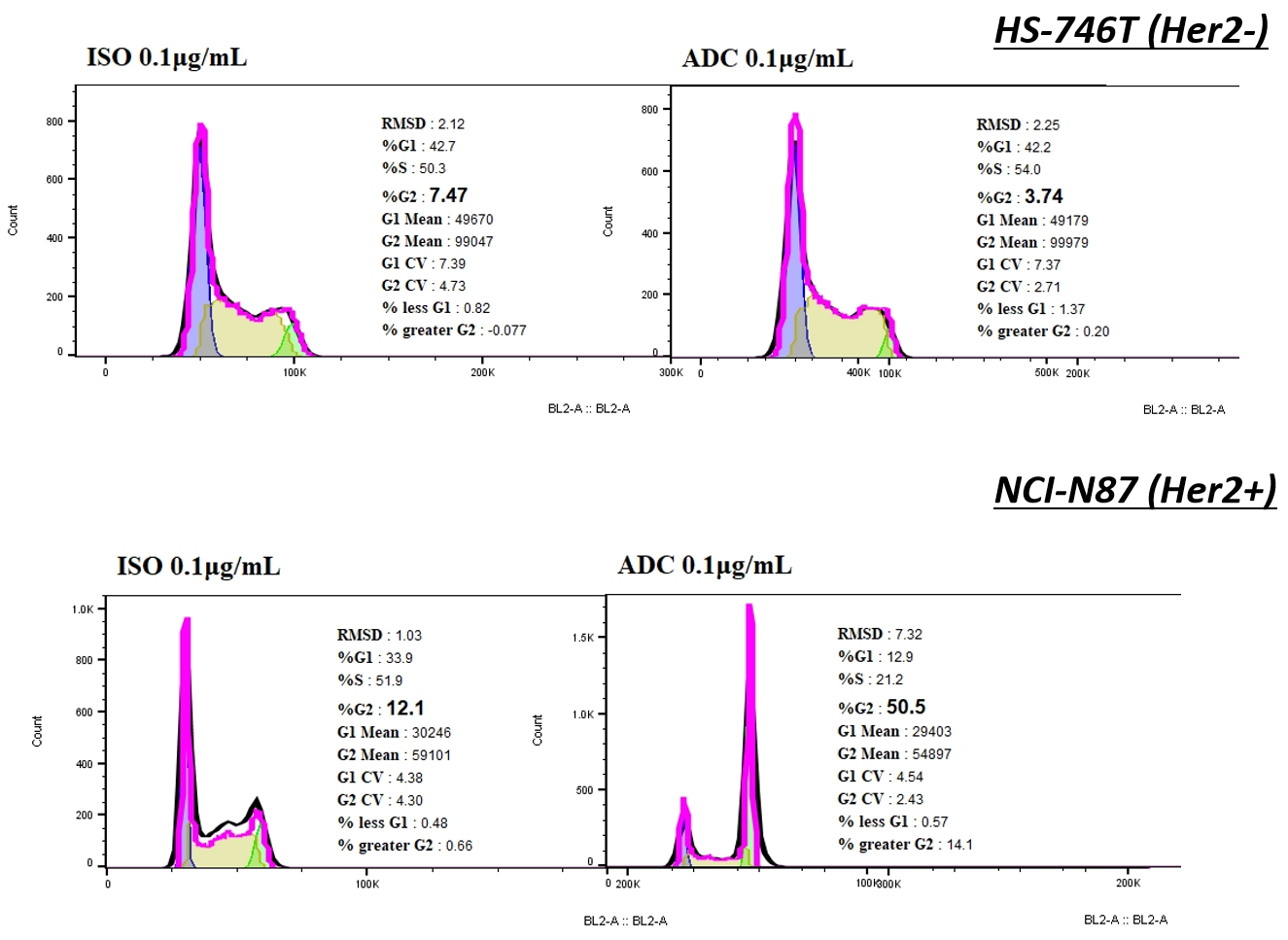
ISO-MMAEと比較して、Her2-MMAEはNCI-N87で細胞周期停止を引き起こし、G2/M期の細胞割合が急激に増加しましたが、HS-746T細胞では観察されませんでした。
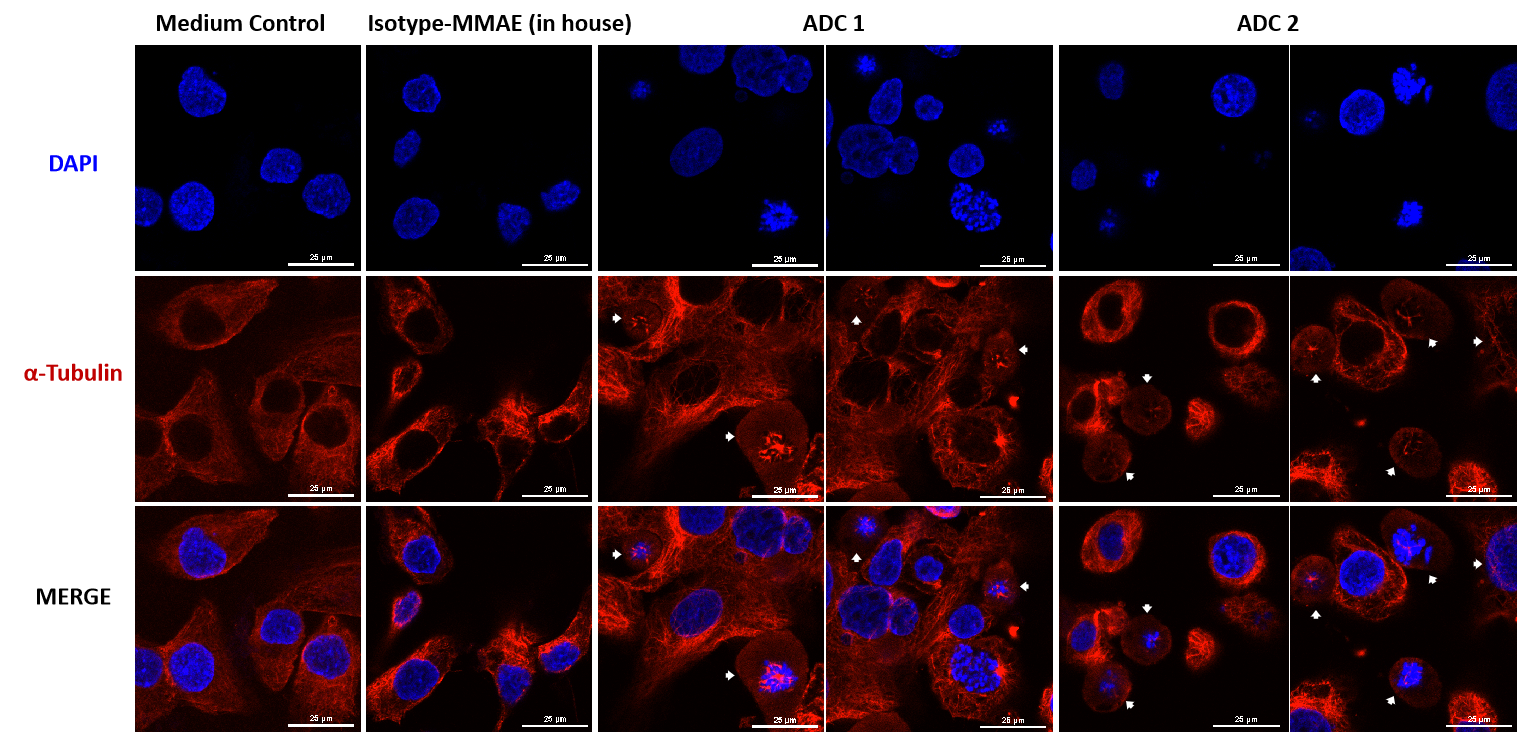
MMAE結合ADCによる細胞内微小管ネットワーク破壊の共焦点顕微鏡観察
SKOV-3(Her2+およびTrop2+)細胞は、MMAE結合ADCで24時間(各ADC10 μg/mL)処理されました。微小管は、PE標識のα-Tubulinマウスモノクローナル抗体(赤色)で染色され、細胞核はDAPI(青色)で染色されました。スケールバーは25μm。
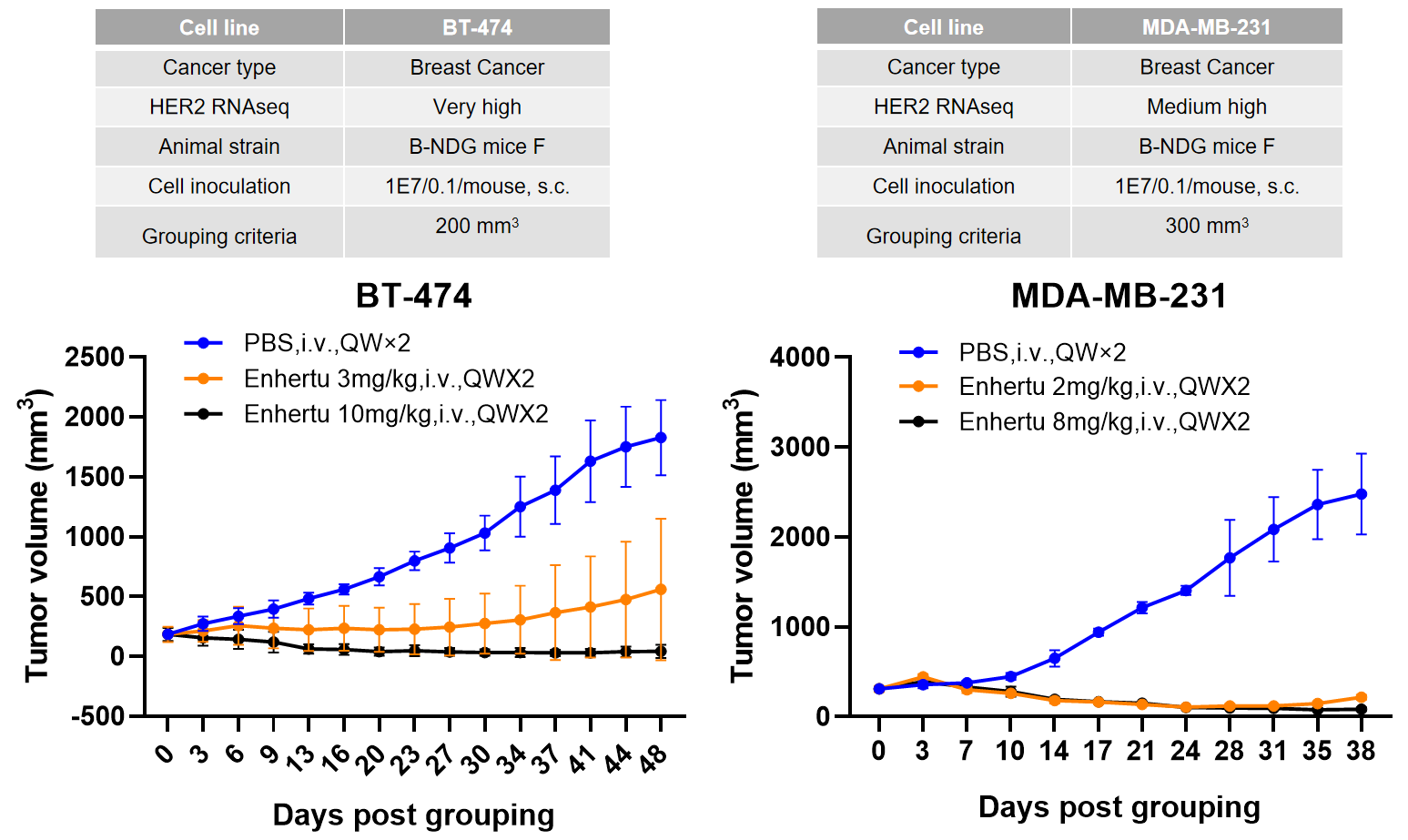
胰腺癌細胞系B-luc MIA Paca-2のOrthotopic接種、Her2-ADC投与後に、腫瘍成長が有意に抑制されました。
ここをクリックしてOrthotopic CDXモデルリストを確認してください
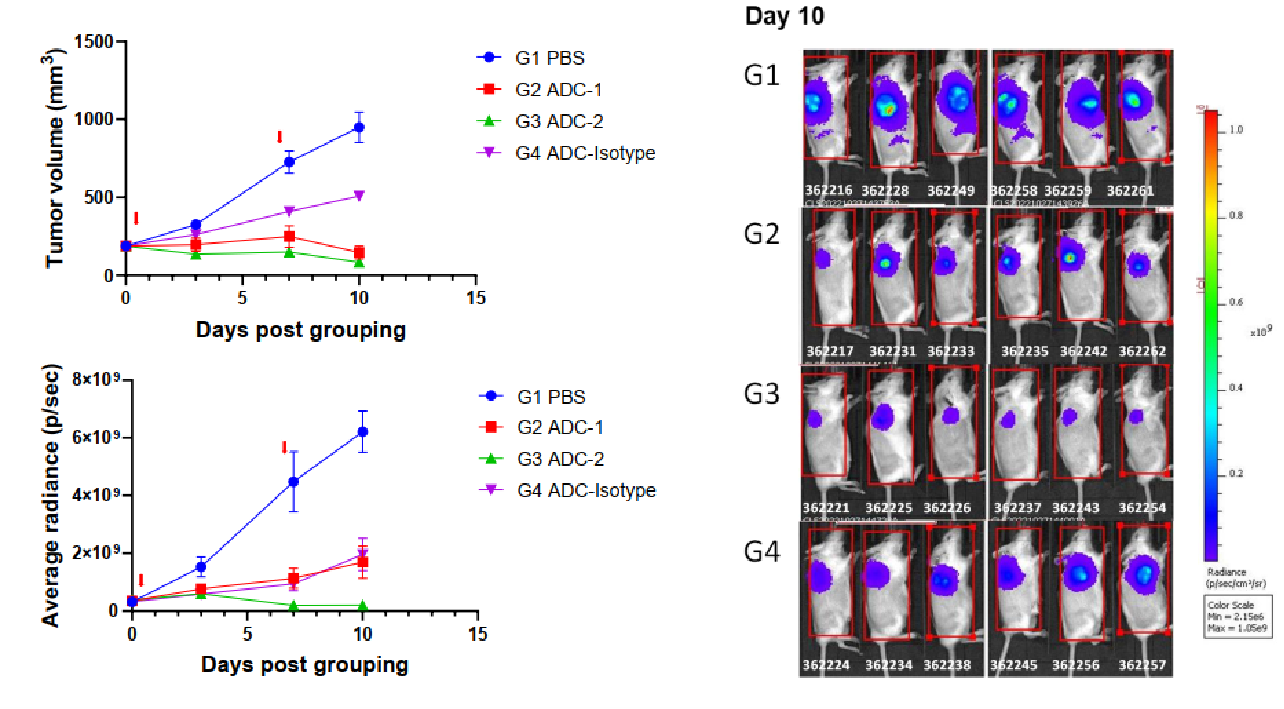
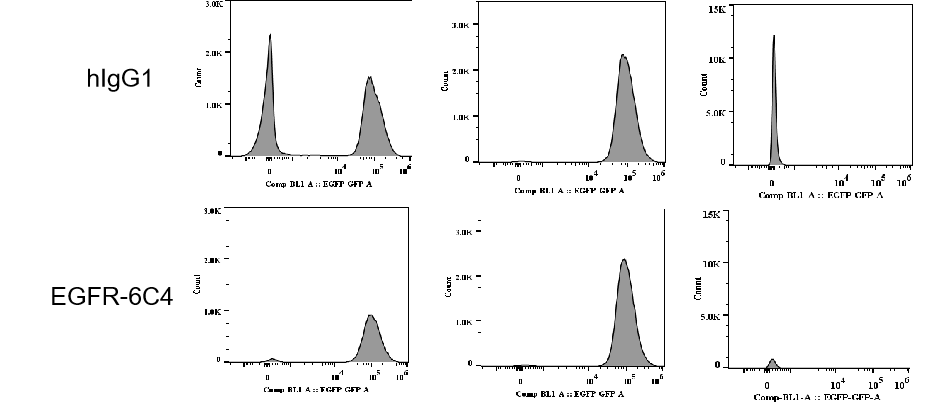
共接種条件下でのin vivoバイスタンダー効果 NCI-H1975(ターゲット陽性)およびB-luc Daudi(ターゲット陰性)細胞の混合物を接種後7日目に、静脈内で抗体薬物複合体(第0日、第7日)を投与されました。静脈内で基質を投与した後、in vivoイメージャーでルシフェラーゼ活性を検出しました。(左上)推定腫瘍体積;(左下)ルシフェラーゼ活性;(右)10日目のルシフェラーゼ活性の画像データ(n=6)。図に示すように、ADC2はB-luc Daudiの成長を有意に抑制しましたが、ADC1は抑制しませんでした。
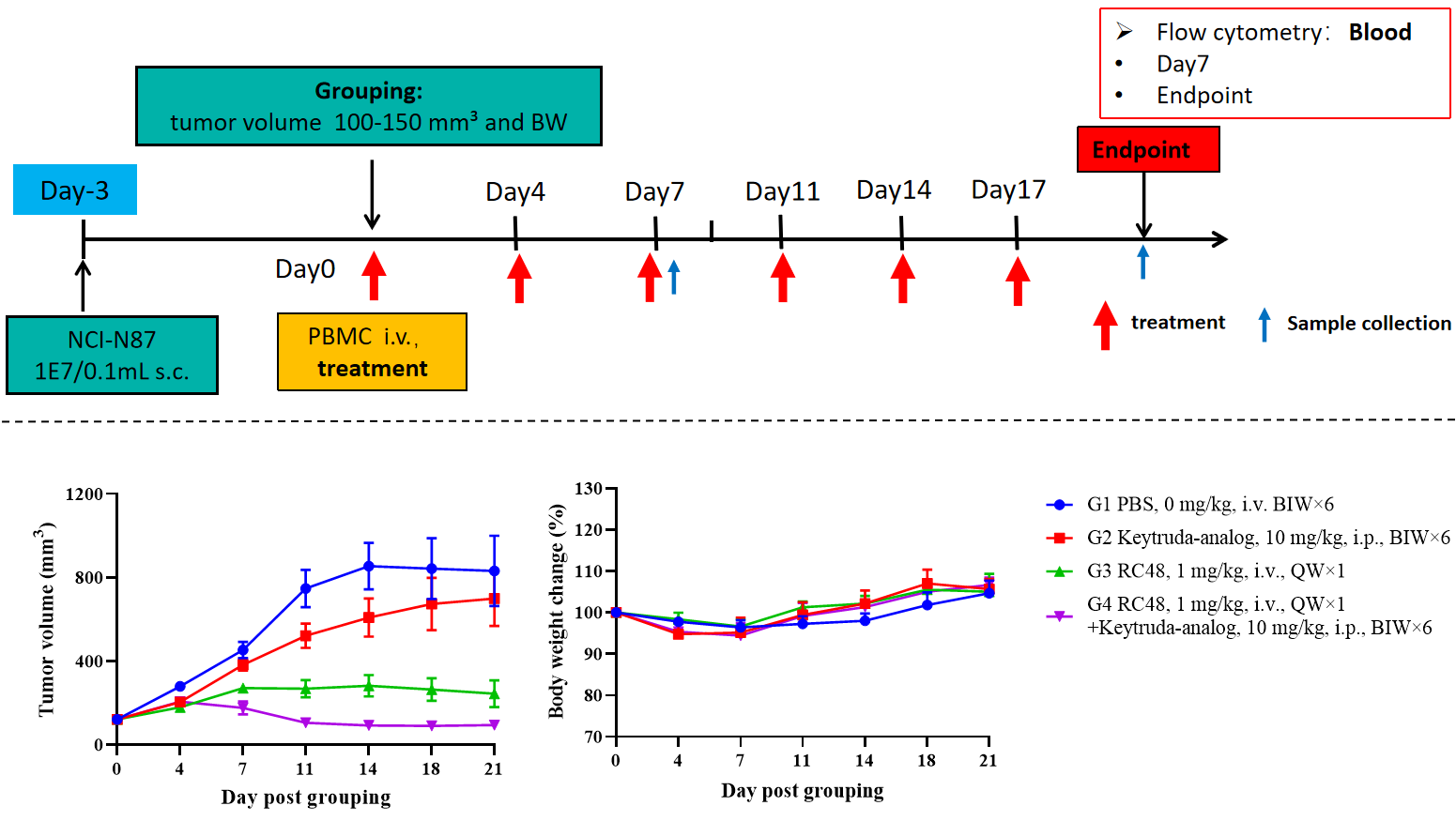
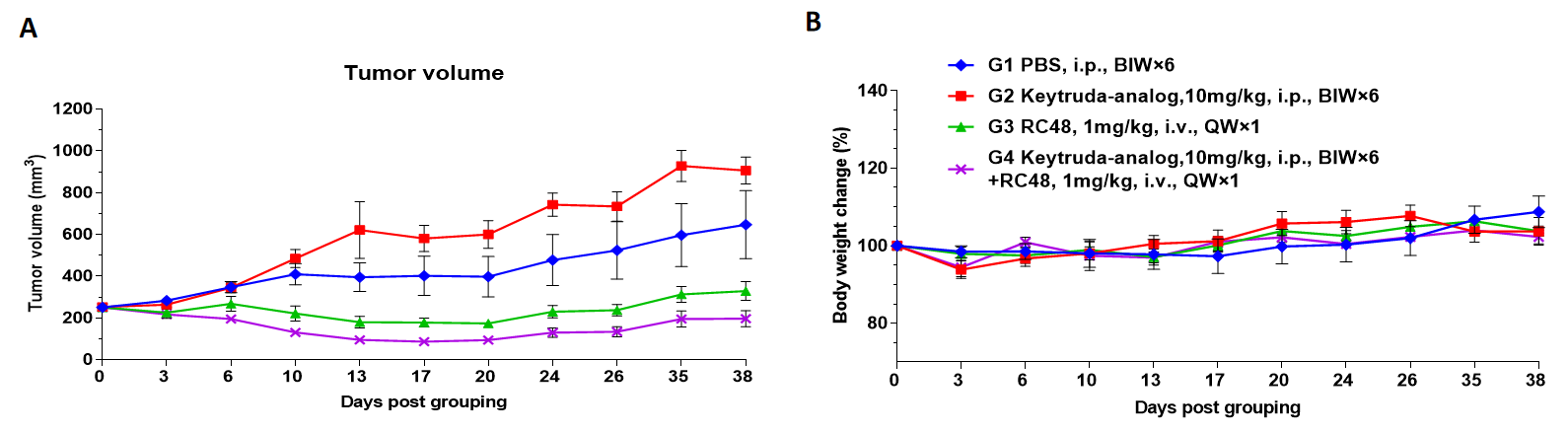
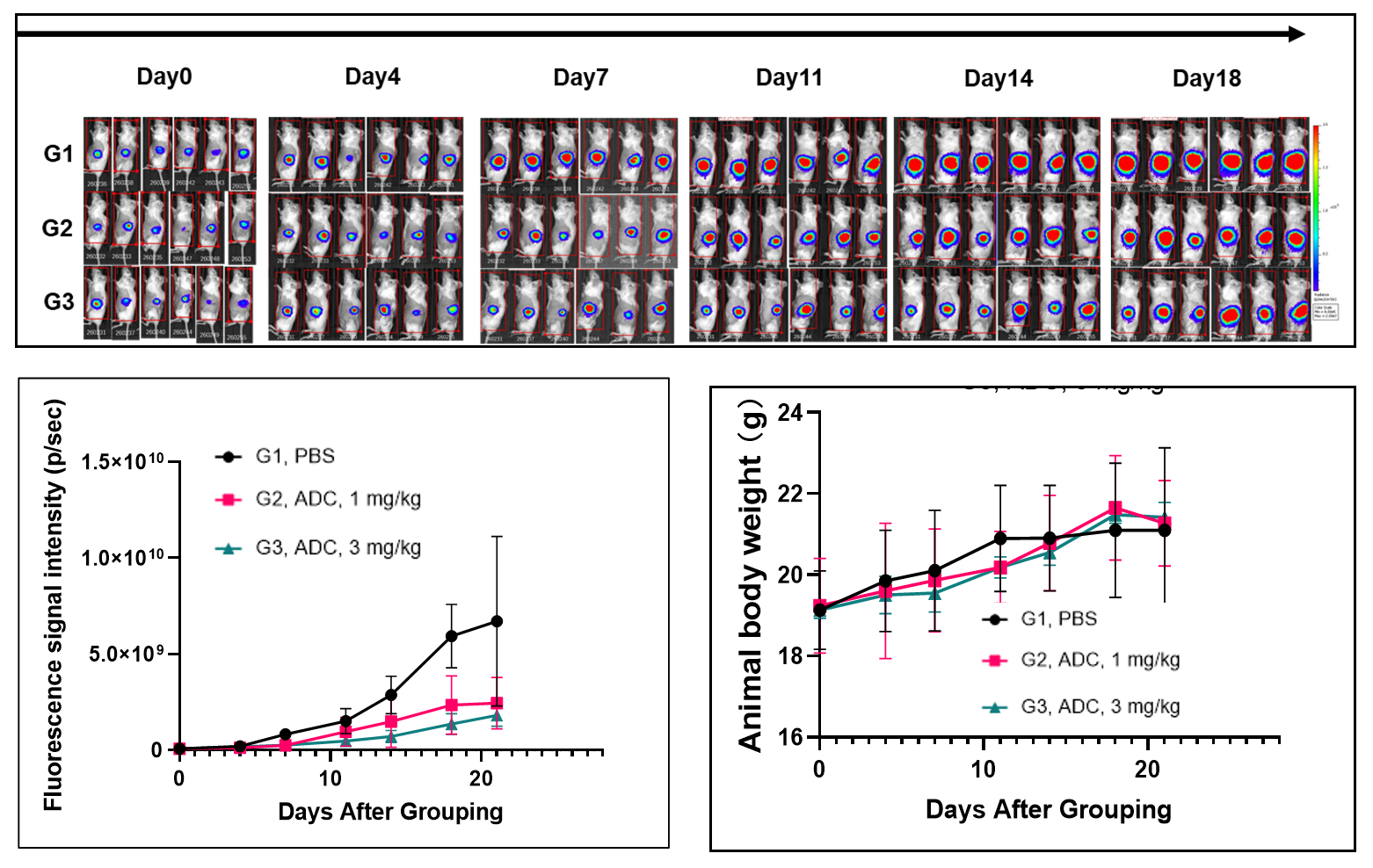
CD34+細胞で再構成されたB-NDG hIL15マウスにおける医薬品有効性試験
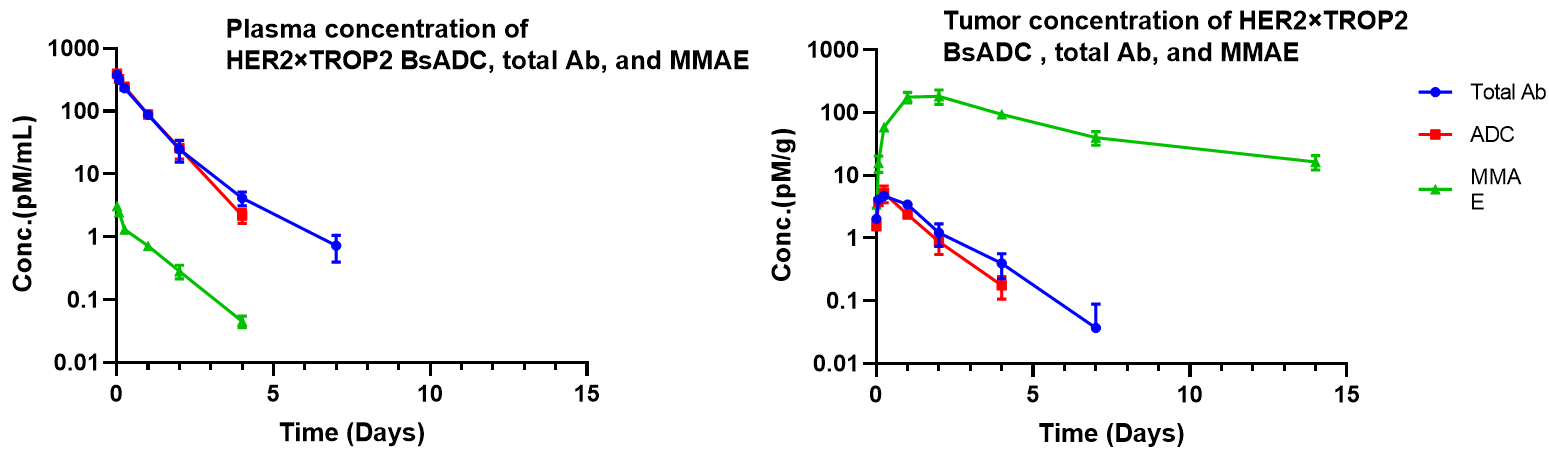
NCI-H1975異種移植モデルにおけるHER2×TROP2 BsADCの薬物動態分析 3 mg/kgのHER2×TROP2 BsADCを1回投与した後、MMAEは腫瘍に蓄積され、血漿中の濃度は低い値を示しました。この結果は、HER2×TROP2 BsADC が MMAE を効率的に腫瘍に標的として送達できるようになり、より優れた抗腫瘍活性を示す可能性があることを示唆しています。