このページで
当社 は、新薬候補の治療可能性を評価するために、高品質の in vivo 有効性試験のエキスパートです。これらの試験では、ヒト標的を対応するマウス遺伝子座にノックインした遺伝子編集マウスモデル、重症免疫不全(B-NDG)マウスとその変異体、そして野生型モデルが活用されます。当社のアプローチは、腫瘍学、免疫腫瘍学、自己免疫疾患および炎症性疾患、代謝疾患、神経疾患など、幅広い疾患領域における創薬開発を支援しています。
単一および二重特異性抗体、組換えタンパク質、抗体薬物複合体(ADC)、ペプチド、腫瘍ワクチン、CAR-T細胞療法、腫瘍溶解性ウイルスを含む幅広い生物製剤の試験に関する専門知識を備え、治療効果の包括的な評価を保証します。
以下のin vivo モデルをご利用いただけます:



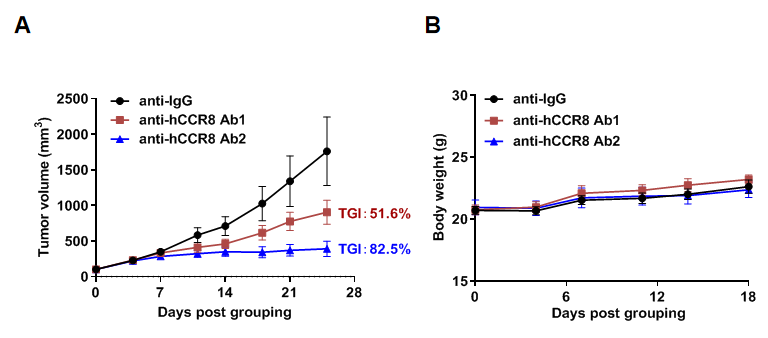
抗ヒトCCR8抗体のB-hCCR8マウスにおけるMC38細胞への抗腫瘍活性 マウス大腸癌MC38細胞をB-hCCR8同種マウス(雌、7週齢、n=6)に皮下移植しました。腫瘍体積が約100 mm3に達した時点で、マウスはグループ分けされ、抗ヒトCCR8抗体(in house)が投与されました。(A)腫瘍成長曲線。(B)治療中の体重変化。示されているように、抗ヒトCCR8抗体はB-hCCR8マウスにおいて、腫瘍の成長を有効に抑制しました。B-hCCR8マウスは、抗ヒトCCR8抗体の in vivo 評価に強力な前臨床モデルを提供します。値は平均±SEMとして表されています。
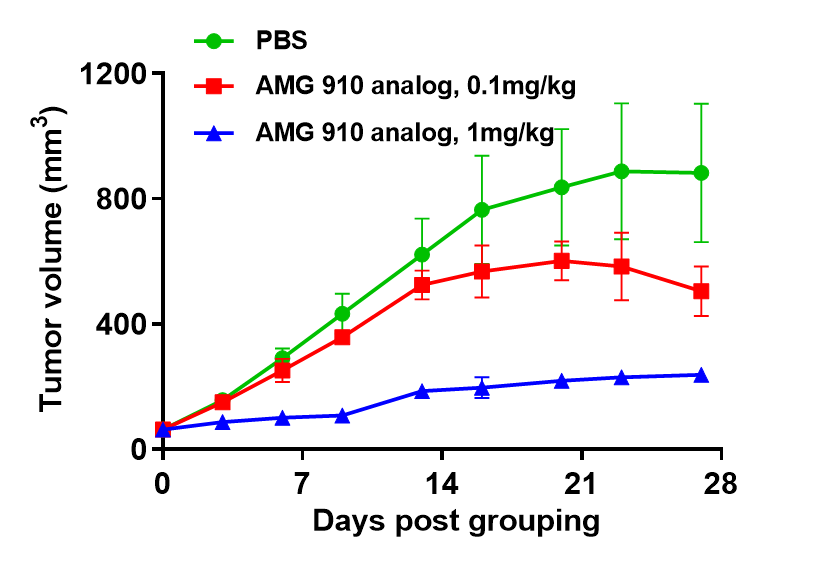
二重特異性抗体のヒト免疫系再構築モデルにおける有効性試験 (A)CD3ベースの二重特異性抗体試験のためのヒト免疫系再構築モデル。B-NDGマウスにヒトのPBMC(5E6)を静脈内投与後、NUGC4細胞(5E6)を皮下移植しました。抗ヒトCD3×Claudin18.2二重特異性抗体(AMG 910類似体)は、PBMC再構築されたB-NDGマウスでNUGC4腫瘍の成長を有意に抑制しました。
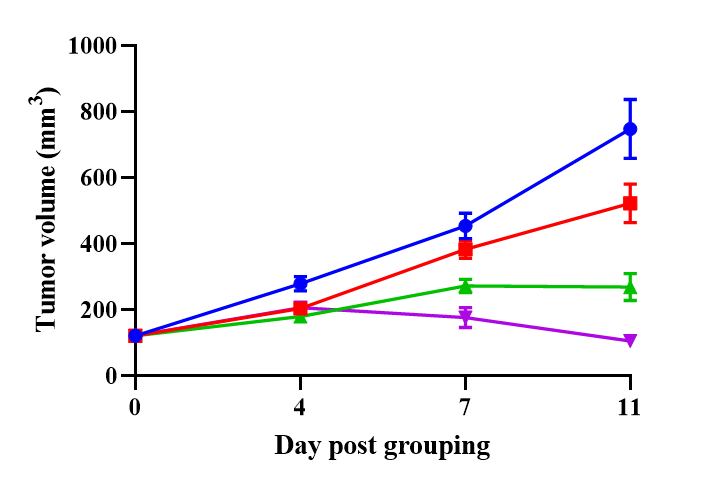
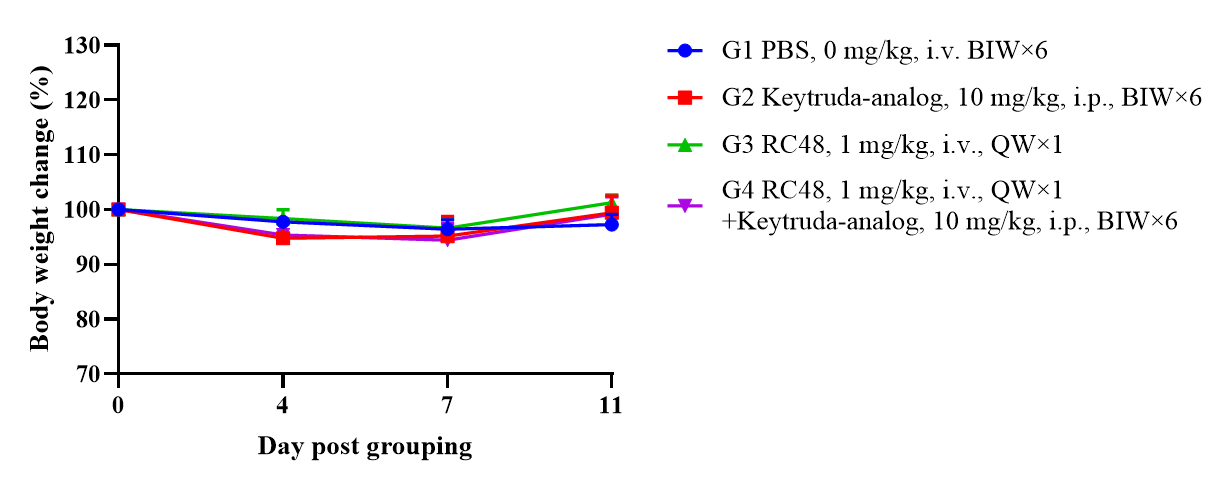
PBMCで再構築されたB-NDGマウスを用いたHER2-ADC有効性試験
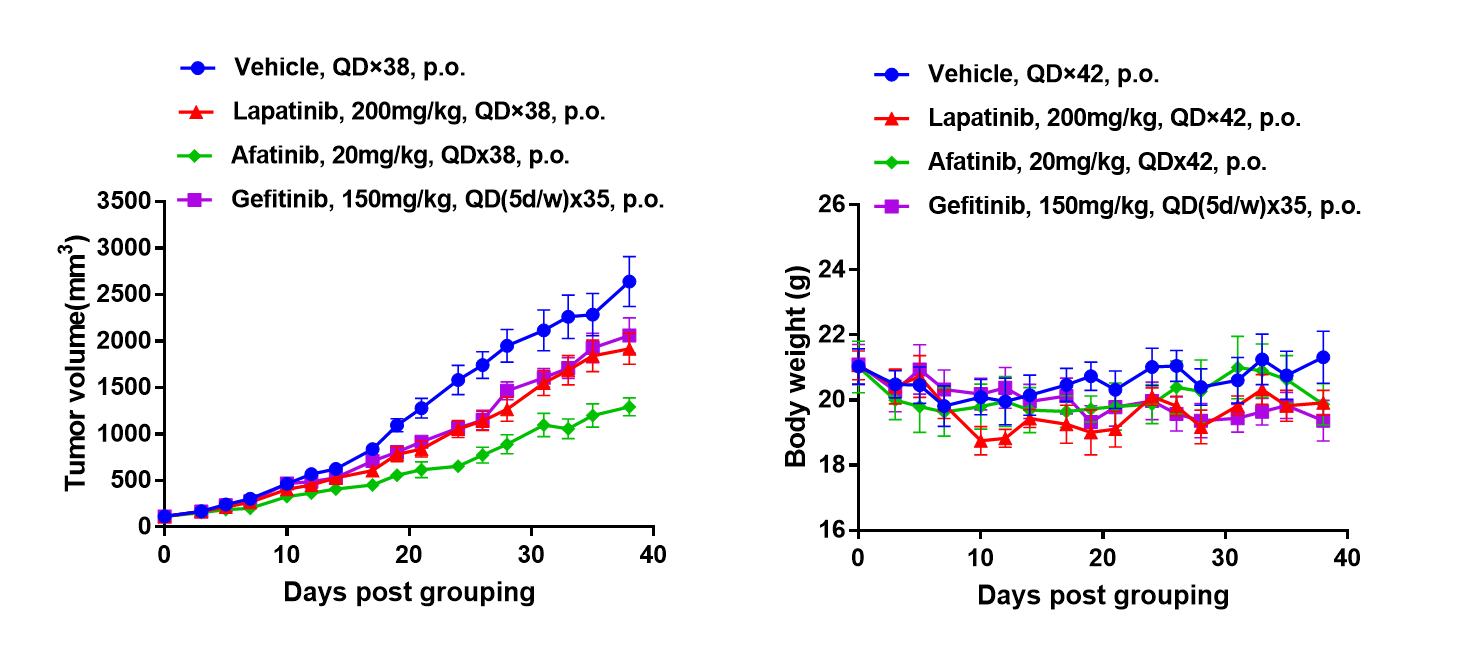
EGFRを標的とした薬物のB-NDGマウスにおける抗腫瘍活性 (A)分子標的低分子抗癌薬がBP0062のB-NDGマウスにおける腫瘍成長をわずかに抑制。BP0062のPDXモデルをB-NDGマウス(雌、6週齢、n=6)に皮下移植しました。腫瘍体積が約100 mm3に達した時点で、マウスはグループ分けされ、図に示された異なる標的薬剤およびスケジュールで投与されました。(B)投与中の体重変化。図Aに示すように、分子標的低分子抗癌薬は有効であり、BP0062のPDXモデルは腫瘍モデルを確立し、EGFR陽性細胞を持つ強力な前臨床膵臓腫瘍モデルを提供することを示しています。値は平均±SEMとして表されています。
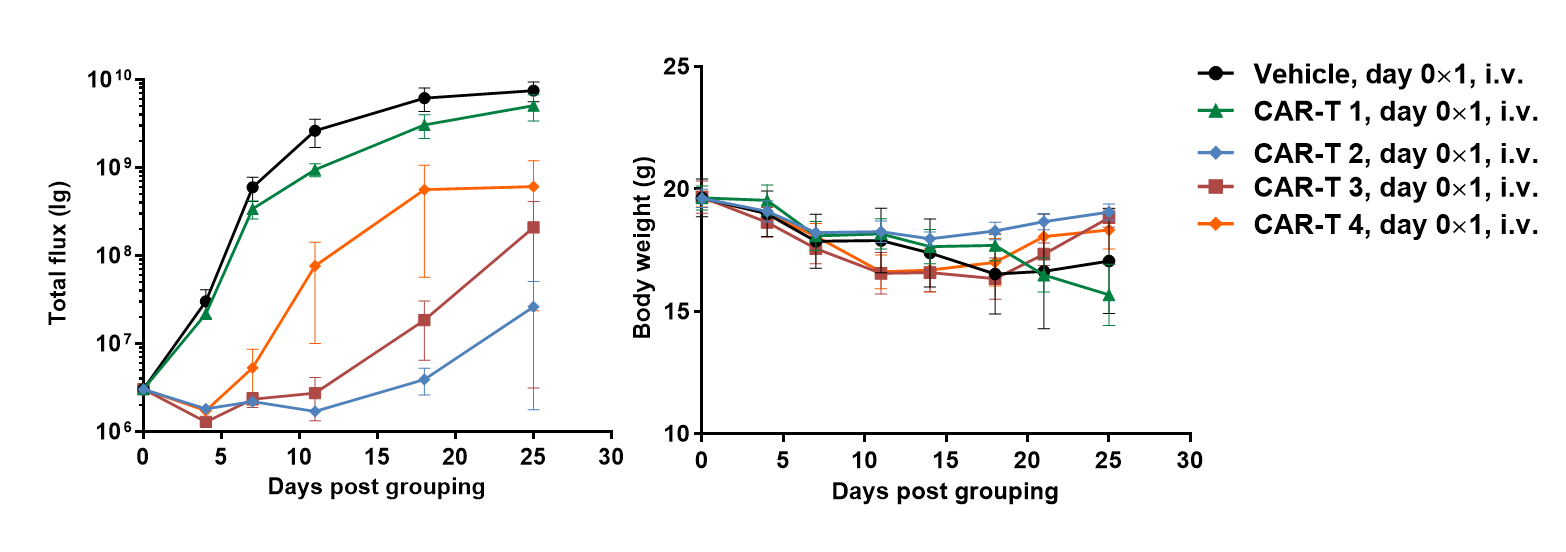
B-NDGマウスを用いてRajiリンパ腫マウスモデルを確立し、抗ヒトCD47抗体の有効性を検証しました。B-luc-GFP Raji細胞(5×105)を尾静脈からB-NDGマウスに投与しました。In vivo イメージングシステム(IVIS)を使用して腫瘍の成長を観察しました。腫瘍の蛍光強度が約1×106 p/secに達した時点で、動物は1つのコントロール群と3つの治療群(n=6)に分けられました。(A)腫瘍細胞の蛍光強度曲線;(B)体重。結果は、3種類の抗ヒトCD47抗体すべてが腫瘍の成長を有意に抑制できることを示しました。B-NDGマウスは、抗ヒトCD47抗体の有効性検証に強力なモデルを提供します。値は平均±SEMとして表されています。