このページで
当社のin vitro細胞機能評価サービスでは、初代細胞および樹立細胞株を用いて、候補抗体のin vitro薬理を評価し、結合能力およびFcおよびFab関連特性を検証しています。評価のアプローチには、フローサイトメトリー、ELISA、HTRF、Incucyte細胞イメージングなどの高度な技術が含まれています。これらの評価は、候補抗体の有効性と毒性メカニズムに関する貴重な知見を提供し、臨床トランスレーショナル研究をサポートします。
in vitro薬理サービスの概要
1. 一般的なアッセイ
2. Fab関連機能アッセイ
非免疫細胞
サイトカイン
3. 免疫細胞ベースのアッセイ
フローサイトメトリー:
IncuCyte:
サイトカイン解析:






Fc関連機能アッセイ
Fab関連機能アッセイ

PBMCはエフェクター細胞として使用しました。標的細胞は高濃度CFSEで標識されたJurkat-h4-1BB細胞で、コントロール細胞は低濃度CFSEで標識されたJurkat WT細胞です。これらの細胞は、さまざまな濃度の抗ヒト4-1BB抗体が存在する状態で18時間培養されます。
細胞毒性率は次のように計算されます:[1 - (コントロールウェル比 / 実験ウェル比)] × 100。比率は、CFSElow細胞の数をCFSEhigh細胞の数で割った値です。
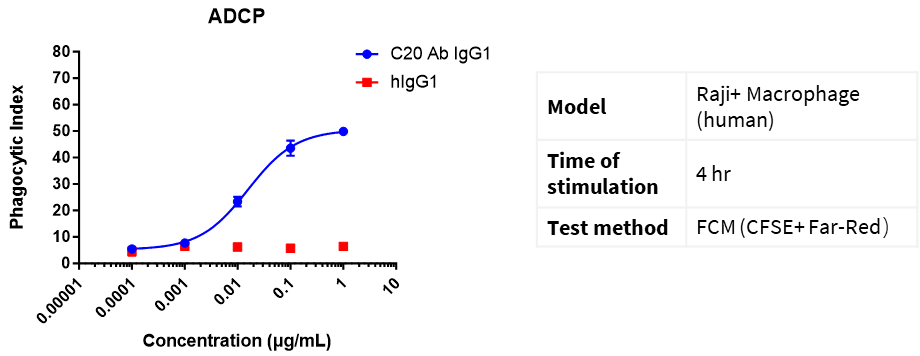
Far Redでマクロファージ(E)を標識し、CFSE染料でRaji細胞(T)を標識しました。E:T = 1:5。異なる濃度のCD20 IgG1抗体を添加し、4時間インキュベートして、フローサイトメトリーでマクロファージの貪食作用を検出しました。
貪食指数(PI)=(貪食したマクロファージの数)/(マクロファージの総数)× 100%
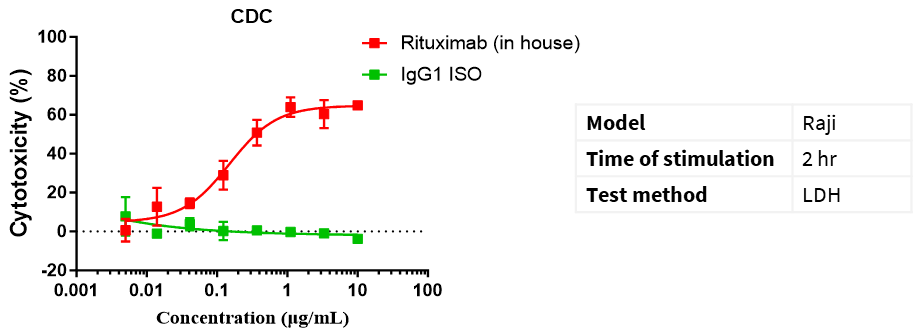
CD20 IgG1抗体を用いたCDCアッセイ Raji細胞を補体存在下で様々な濃度のCD20 IgG1抗体と混合し、2時間インキュベートします。抗体の細胞毒性効果はLDH法で検出されます。
細胞毒性% = (テスト孔のLDH値 − 自発放出孔のLDH値)/(標的細胞の最大LDH放出値 − 自発放出孔のLDH値)× 100%
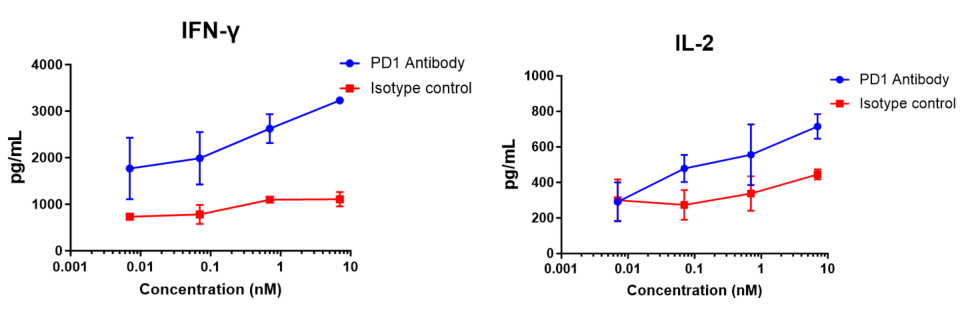
ヒトCD4+ T細胞と同種異系樹状細胞を10:1の比率で96ウェル丸底プレートに混合し、異なる濃度のnivolumab(in house)を添加し、120時間後にELISAでIFN-γの放出を測定しました。結果は、nivolumab(in house)がMLRでIFN-γおよびIL-2の産生を用量依存的に増強したことを示しました。
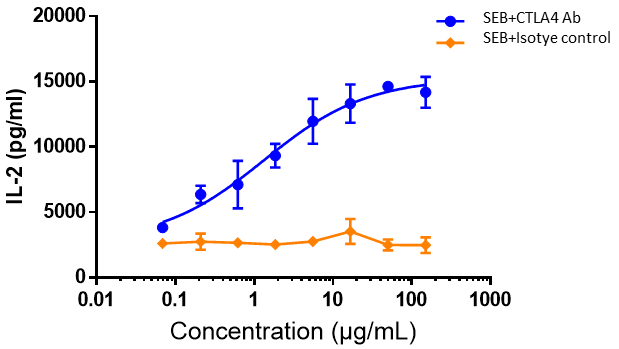
ヒトPBMCをSEB(10 ng/mL)と共にインキュベートし、その後、異なる濃度のipilimumabまたはアイソタイプコントロール抗体を添加し、48時間さらにインキュベートしました。ELISAでIL-2の放出を測定しました。結果は、ipilimumabがSEB刺激PBMCのIL-2産生を用量依存的に増強したことを示しました。
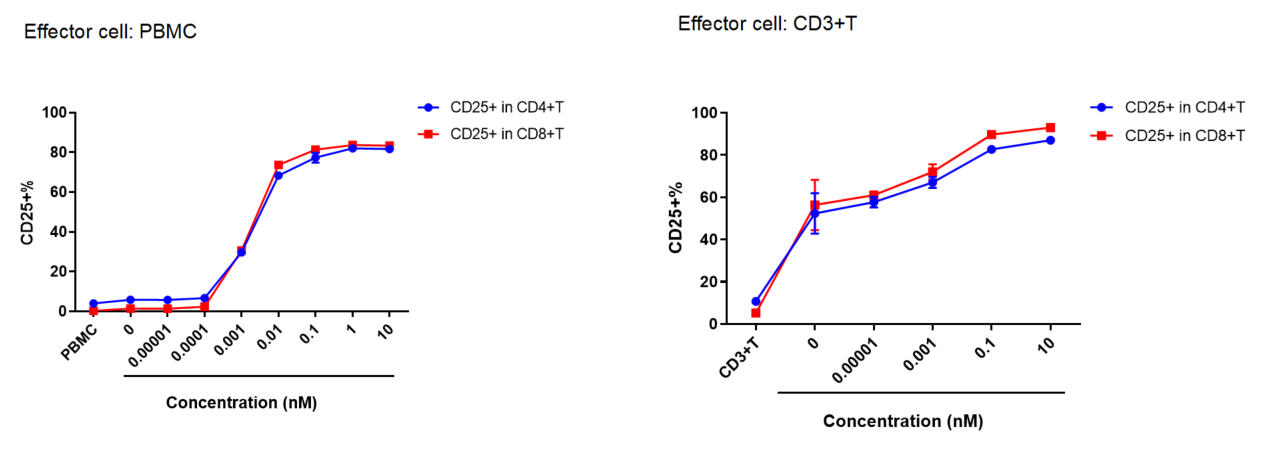
PBMCまたはCD3+ T細胞をDaudi細胞と共培養し、さまざまな濃度のCD3、CD19二重特異性抗体(BiTE)を添加しました。
48時間後、CD4およびCD8 T細胞の活性化が検出されました。抗体濃度が増加するにつれて、活性化されたT細胞(CD25+)が顕著に増加しました。



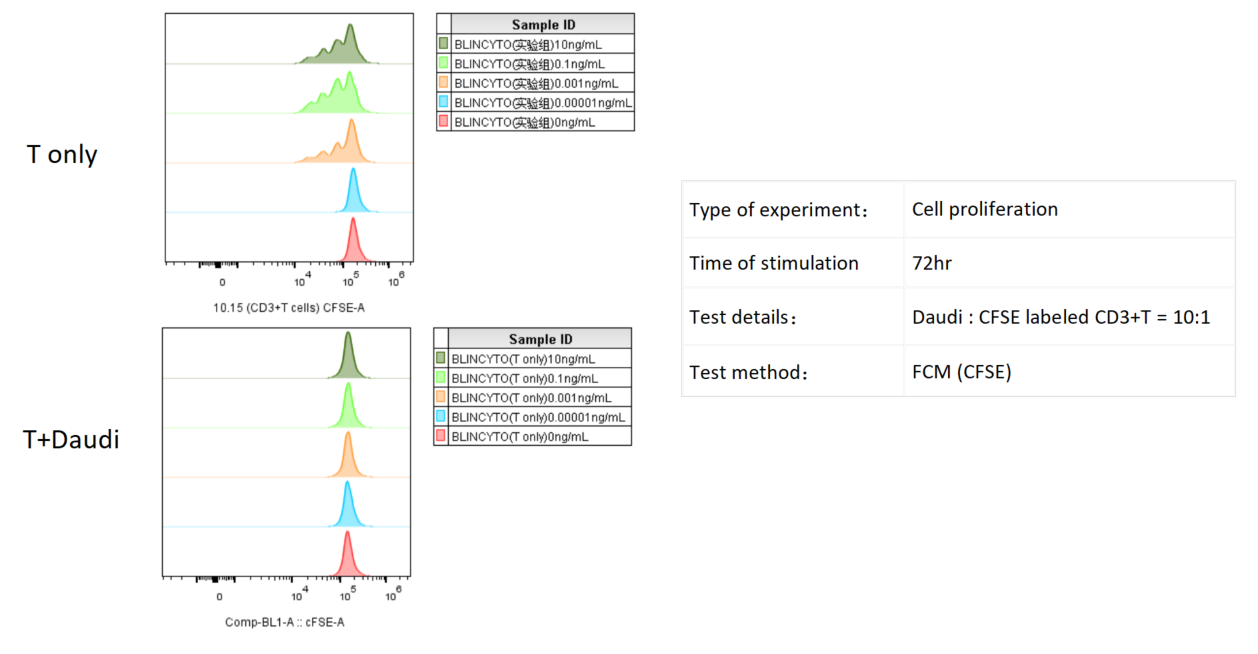
Daudi細胞をCFSE標識されたCD3+ T細胞と共にインキュベートし、さまざまな濃度のBlinatumomabで処理しました。T細胞の増殖はフローサイトメトリーで3日後に評価され、Daudi細胞が存在する場合、Blinatumomabの濃度が高くなるとT細胞の増殖が顕著に増加しました。
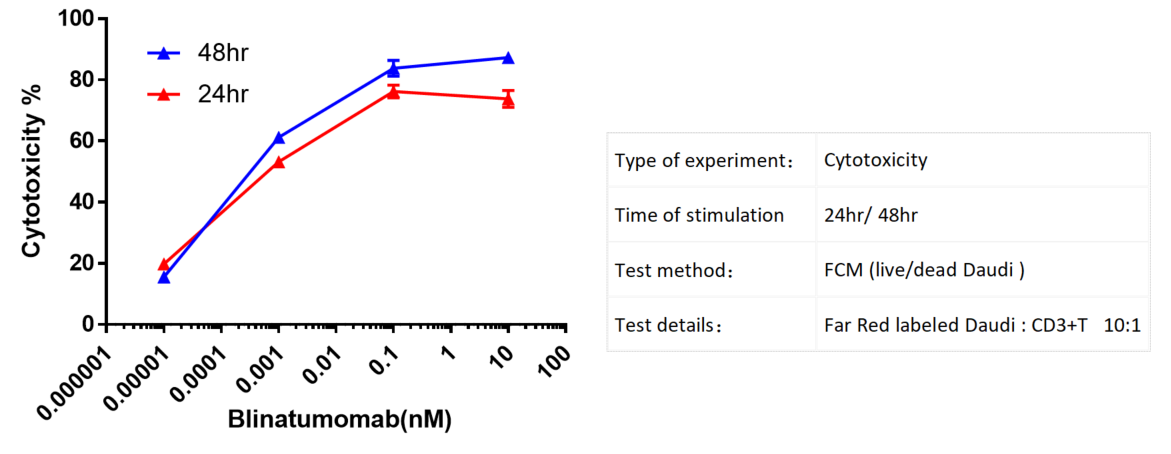
Far Redで標識されたDaudi細胞をCD3+ T細胞と共にインキュベートし、さまざまな濃度のBlinatumomabで処理しました。24時間および48時間後にフローサイトメトリーで細胞毒性を評価しました。抗体の濃度が増加するにつれて、細胞毒性が顕著に増強されました。
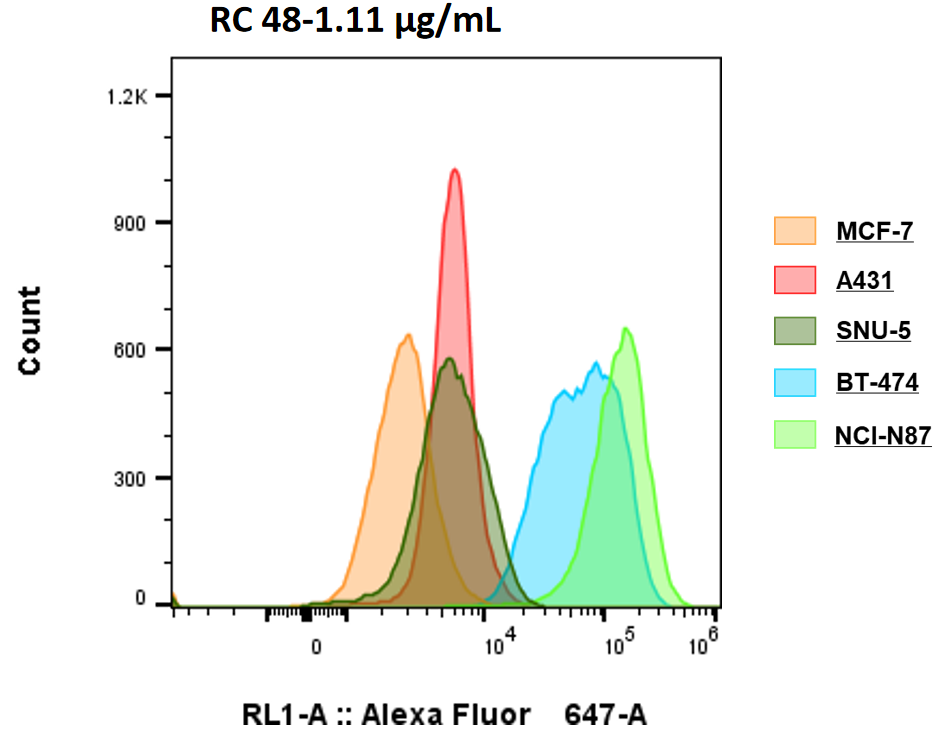
フローサイトメトリーで5つの細胞株のHer2発現を検出
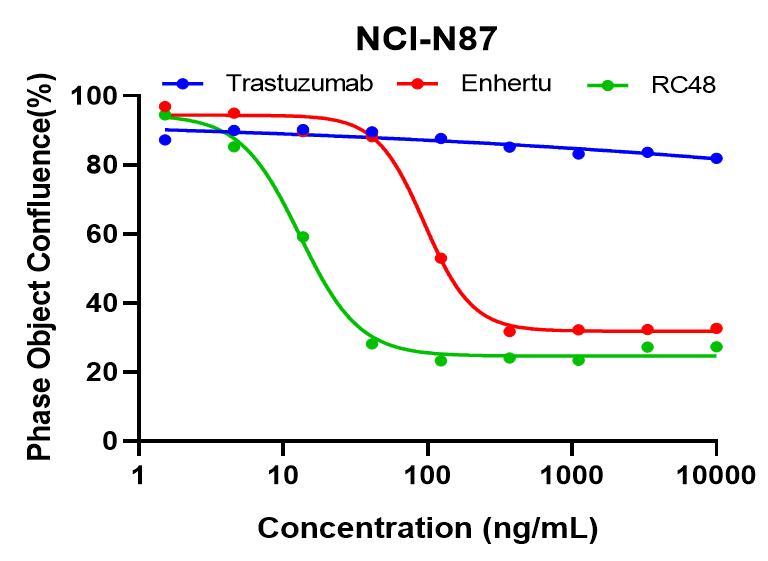
NCI-N87細胞は、異なる濃度のトラスツズマブ、Enthertu、またはDisitamab Vedotin(RC48)で処理され、細胞コンフルエントはIncucyteで継続的にモニタリングされました。図は処理後6日間の細胞コンフルエンスを示しています。EnthertuまたはRC48は、NCI-N87の増殖を濃度依存的に有意に阻害しましたが、トラスツズマブでは阻害は見られませんでした。

NCI-N87、MCF-7、BT-474細胞は、それぞれFabFluorでラベル付けされたDisitamab Vedotin(RC48)またはトラスツズマブと24時間インキュベートされ、Incucyteで継続的に観察されました。写真のオレンジ色の信号は、内因された抗体を示しています。Disitamab Vedotin(RC48)およびトラスツズマブは、NCI-N87(高HER2発現)およびBT-474(高HER2発現)細胞に時間依存的に内因されましたが、MCF-7(HER2発現なし)細胞では内因されませんでした。
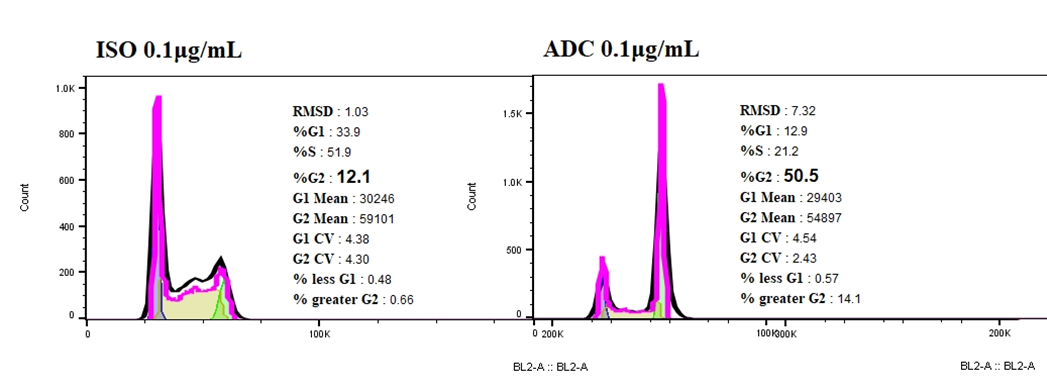
ISO-ADCと比較して、Her2-ADCはNCI-N87細胞で細胞周期の停止を引き起こし、G2期の細胞割合が急激に増加しました。
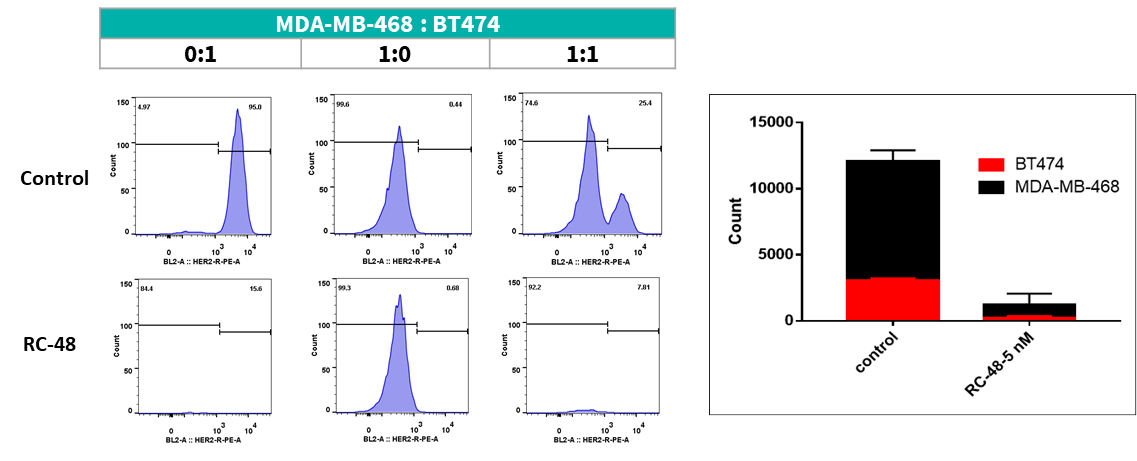
MDA-MB-468細胞(HER2-)およびBT474(HER2+)細胞は、異なる比率(それぞれ0:1、1:0、1:1)で一晩共培養しました。RC48またはビークルで5日間処理した後、フローサイトメーターを用いてHER2陽性細胞とHER2陰性細胞の細胞数と比率を測定しました。RC48はBT474細胞に対して優れた殺腫瘍効果を示しましたが、MDA-MB-468細胞に対してはほとんど細胞毒性を示しませんでした。重要なのは、MDA-MB-468細胞がBT474細胞と共培養されると、RC48がMDA-MB-468細胞を殺傷できたことです。
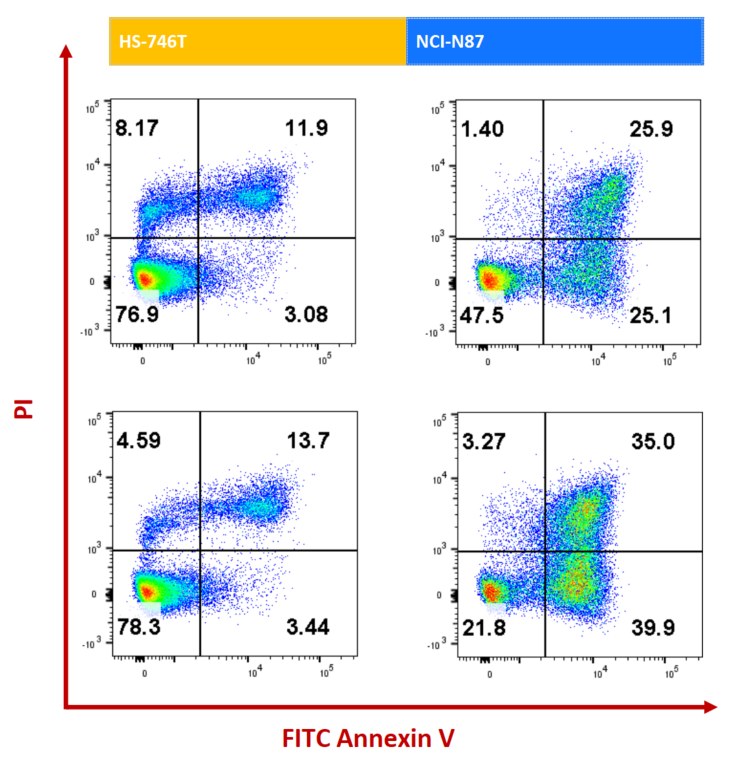
NCI-N87(HER2+)およびHS-746T(HER2-)細胞は、それぞれISO-MMAEおよびEnthertuで72時間処理されました。アポトーシスはAnnexin V/PIキットを使用してフローサイトメトリーで検出されました。HER2高発現のNCI-N87細胞において、Enthertuは有意にアポトーシスを誘導しました。
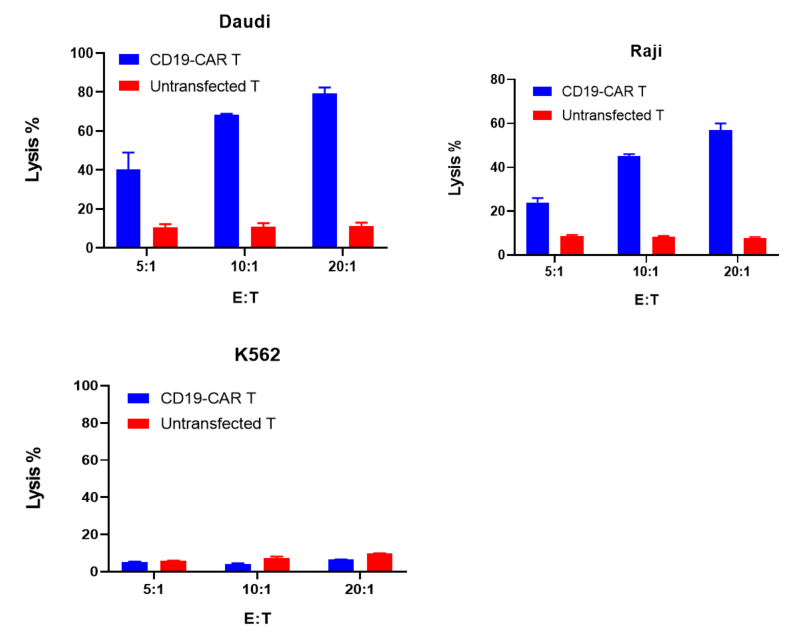
CD19-CAR T細胞または未転送T細胞は、それぞれ5:1、10:1、20:1の異なる比率でDaudi、Raji、K562のターゲット細胞と共培養され、24時間後に細胞毒性がFixable Viability Dyeでフローサイトメトリーにより評価されました。
結果は、CD19-CAR T細胞が、CD19を発現するDaudiおよびRaji細胞に対して有意な細胞毒性を示しました。しかし、CD19-CAR T細胞は、CD19陰性のK562細胞に対して特異的な細胞毒性を示しませんでした。
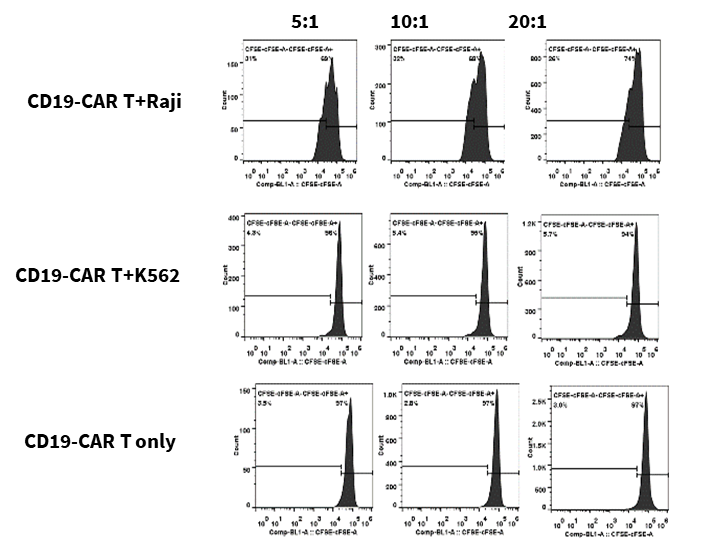
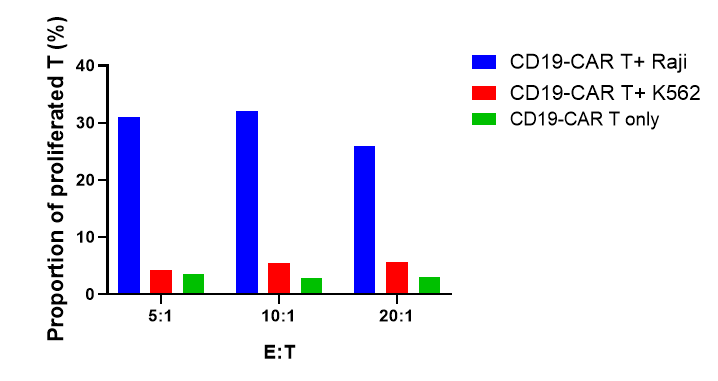
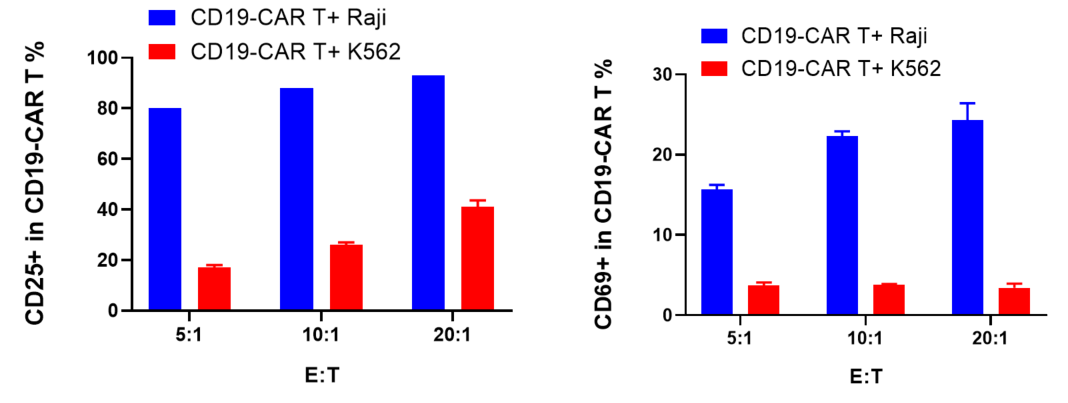
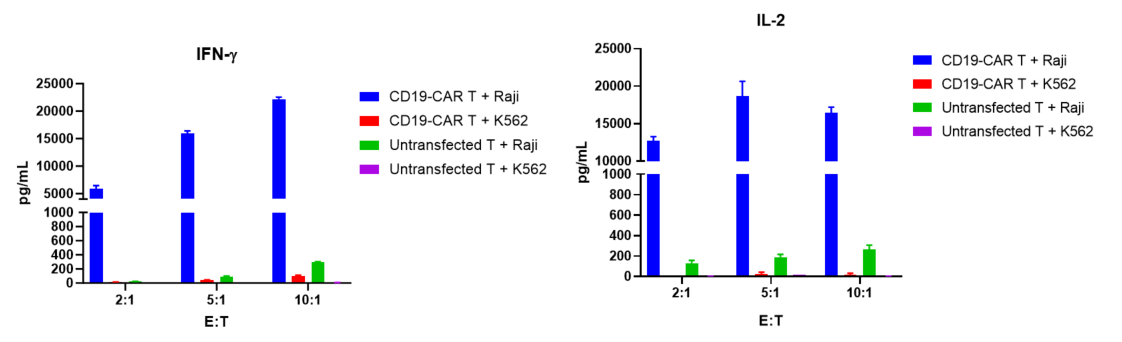
CFSEでラベル付けされたCD19-CAR T細胞は、RajiおよびK562のターゲット細胞と5:1、10:1、20:1の異なる比率で共培養され、72時間後にCD19-CAR T細胞の増殖、活性化、および細胞因子の放出が評価されました。
結果は、CD19-CAR T細胞がCD19を発現するRaji細胞と共培養することで、K562細胞(CD19陰性)と比較して有意に増殖、活性化、および細胞因子放出が起こることを示しました。
FACS
Cytokine
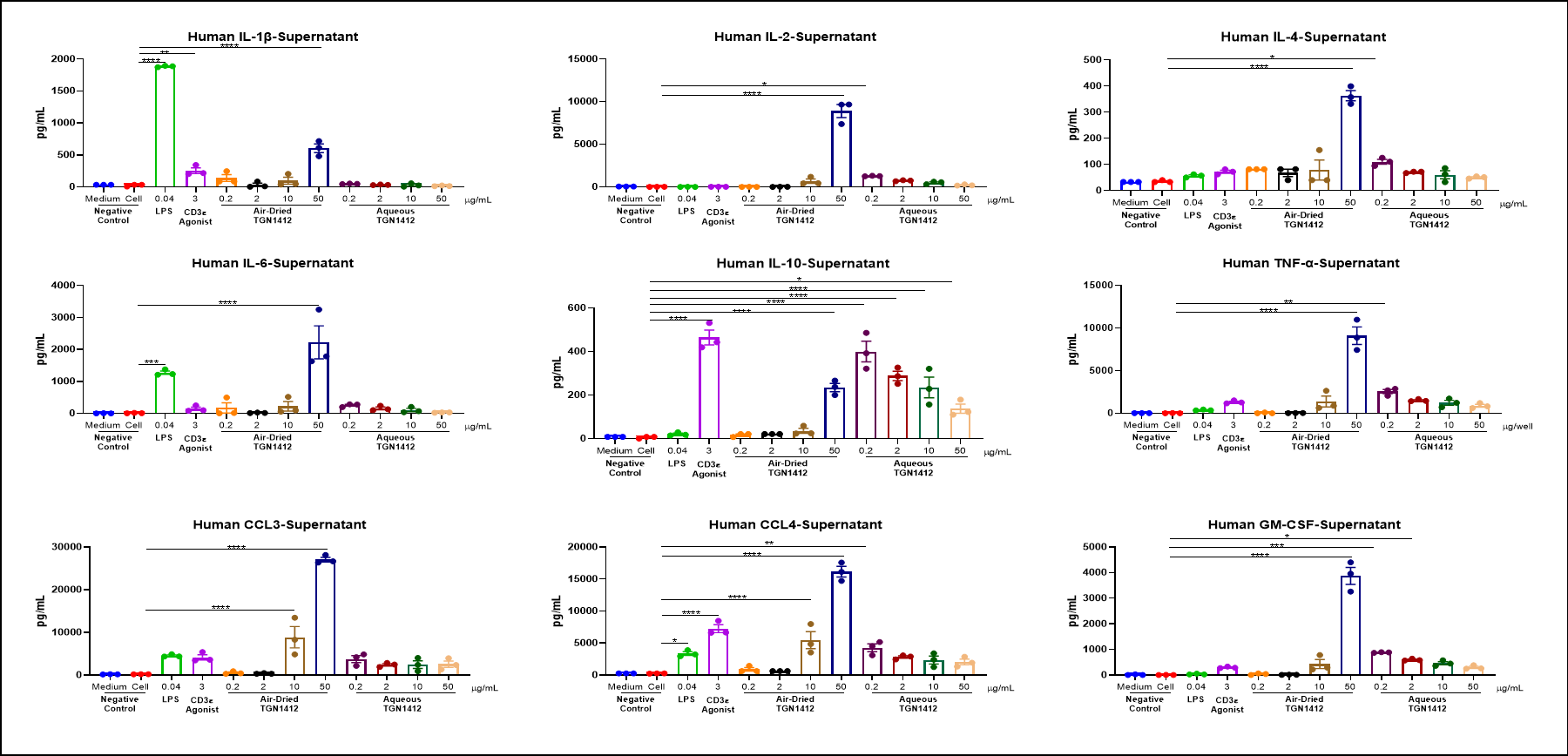
空気乾燥したTGN 1412は、in vitroでPBMCのサイトカインストームを誘発する可能性があります。
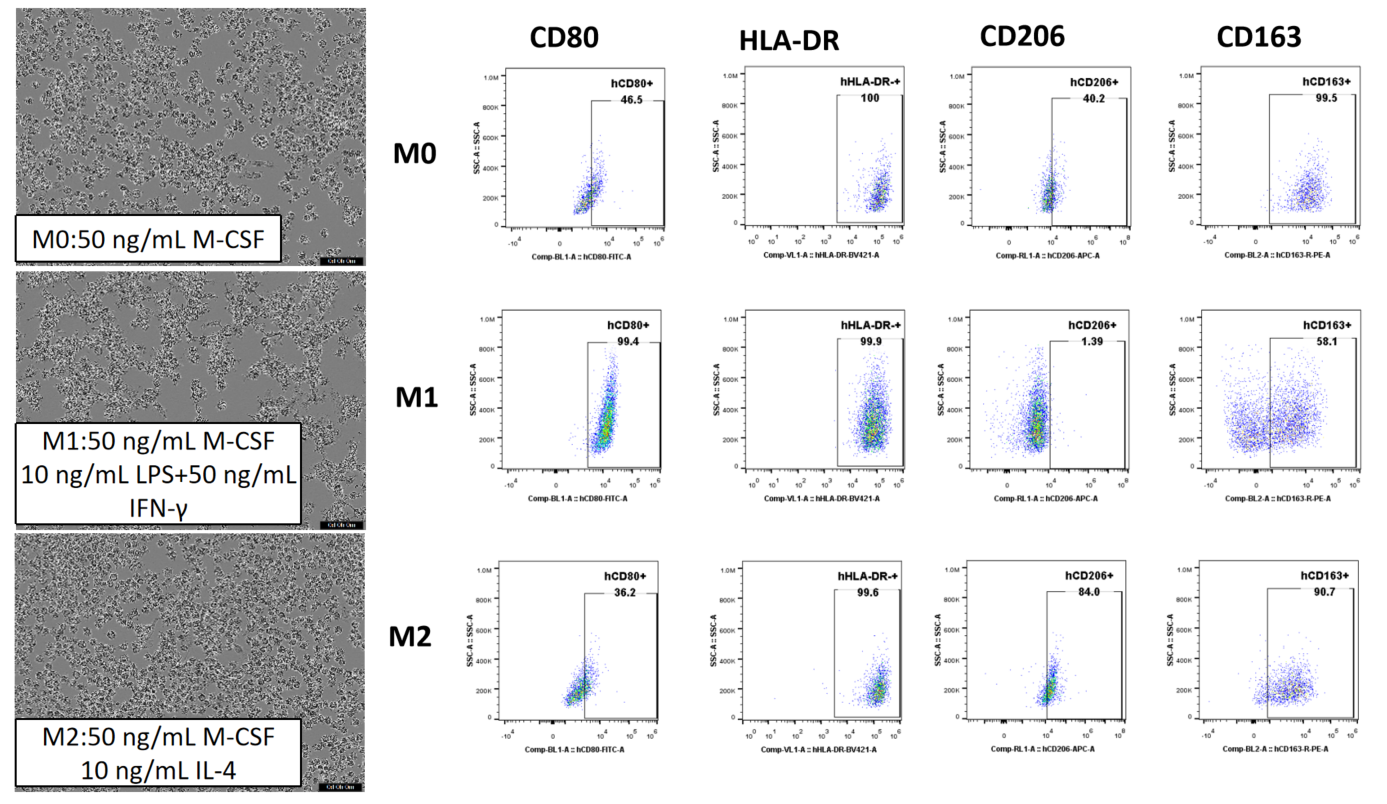
CD14+単球はヒトPBMCsから磁気ビーズを使用して分離され、その後異なるサイトカインで6日間培養されました。これにより、誘導条件に応じて異なる形態と表面マーカーを持つマクロファージが生成されました。
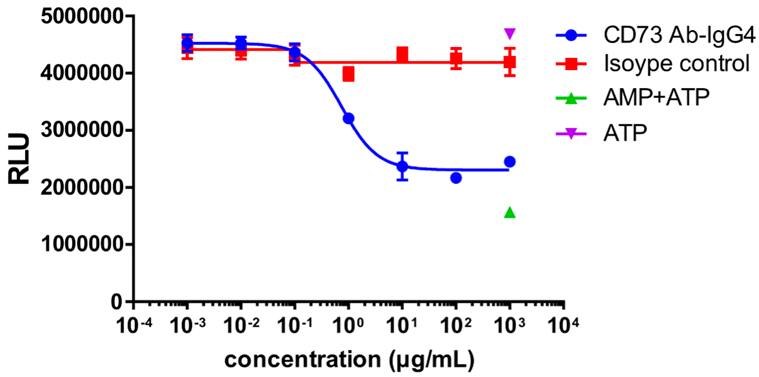
MDA-MB-231細胞をターゲット細胞として使用し、異なる濃度のCD73抗体と37°Cで30分間インキュベートしました。AMPを加え3時間インキュベートした後、ATPとルシフェラーゼ+基質を加え、蛍光値を測定しました。
CD73抗体の濃度が増加するにつれて、CD73酵素活性は抑制され、蛍光値が減少しました。
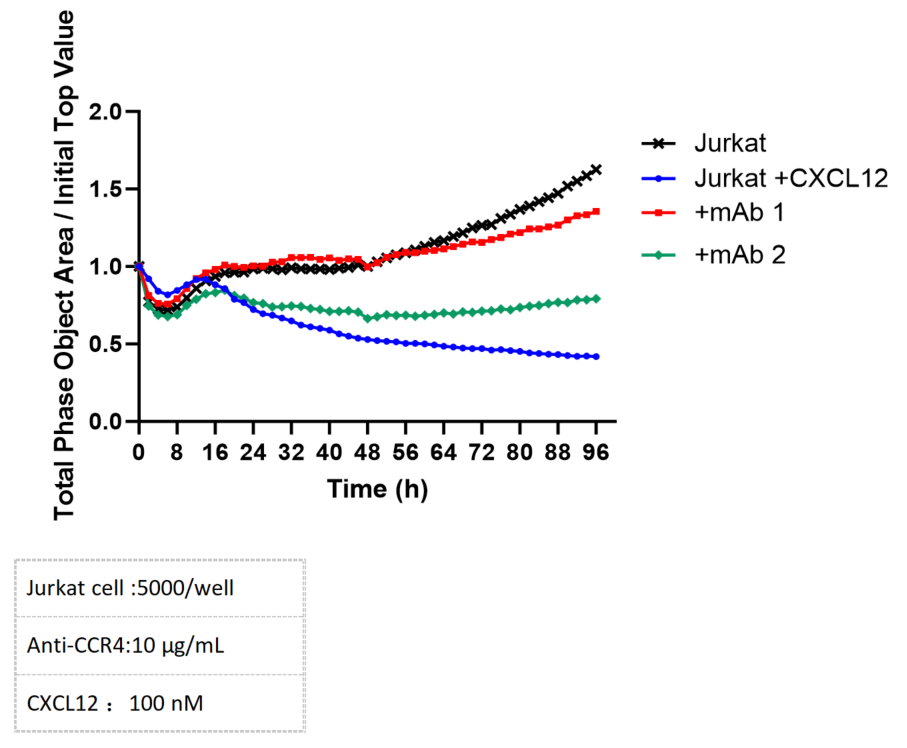
走化性遊走は、Incucyteシステムを使用して正確にモニタリングできます。CXCR4発現のJurkat細胞のCXCL12への遊走反応は、CXCR4特異的抗体の投与によって有効に抑制されます。