このページで
肥満は、基礎代謝率、エネルギー消費、食物摂取量などの内因性および環境要因の不均衡から生じる慢性疾患です。過剰なカロリー摂取とエネルギー密度の高い食事が肥満の主な原因です。肥満に関連する合併症を研究するために、代替動物モデルが開発されてきました。当社は、糖尿病に関連する病理生理学的変化を研究するために、60%のエネルギーが脂肪由来の高脂肪食誘発マウスモデルを開発しました。
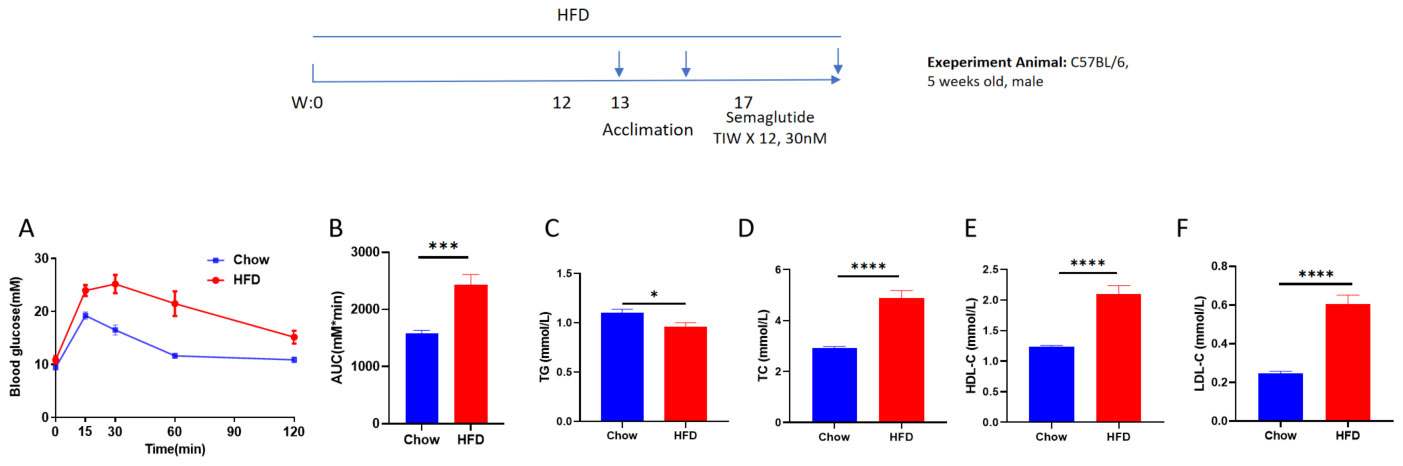
高脂肪食誘発肥満(DIO)マウスモデルの特徴 A、HFD誘導後のグルコース耐性。B、Aの曲線下面積。C-F、HFD誘導後の血液生化学的分析。データは平均±標準誤差(SEM)として示されています。各グループN = 10匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
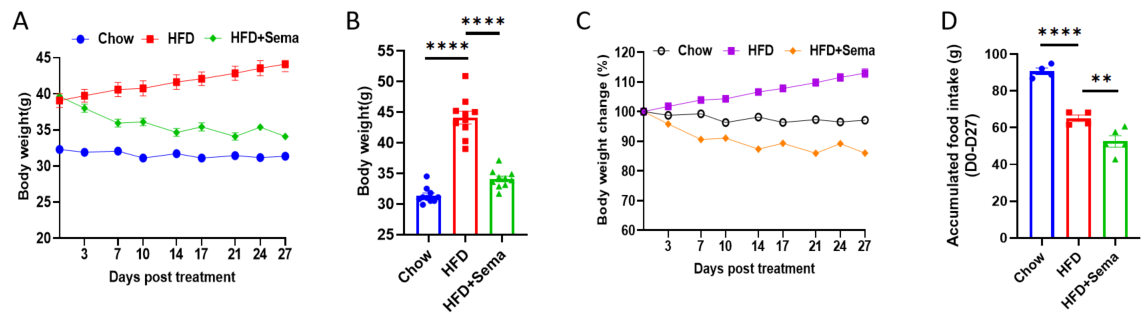
SemaglutideのHFD誘発マウスモデルにおける有効性 A-C、Semaglutide治療後の体重変化と最終体重。D、治療期間中の累積食物摂取量。DIOマウスは体重が約40gに達した時点でグループ分けされました。各グループN = 10匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
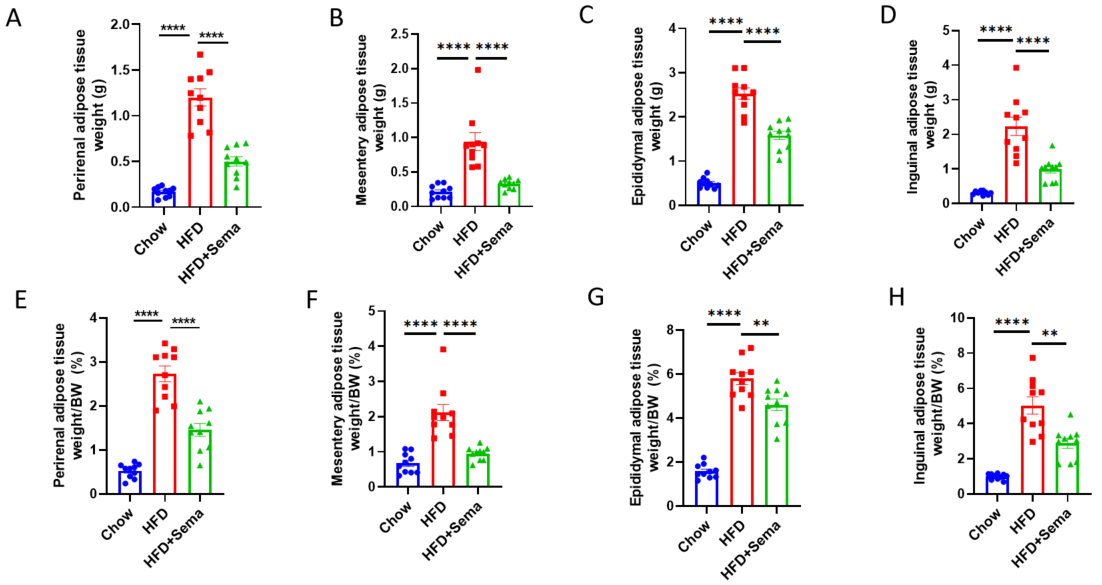
SemaglutideのHFD誘発マウスモデルにおける有効性 A-D、治療後の脂肪組織重量。E-H、治療後の脂肪組織重量と体重の比率。データは平均±標準誤差(SEM)として示されています。各グループN = 10匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
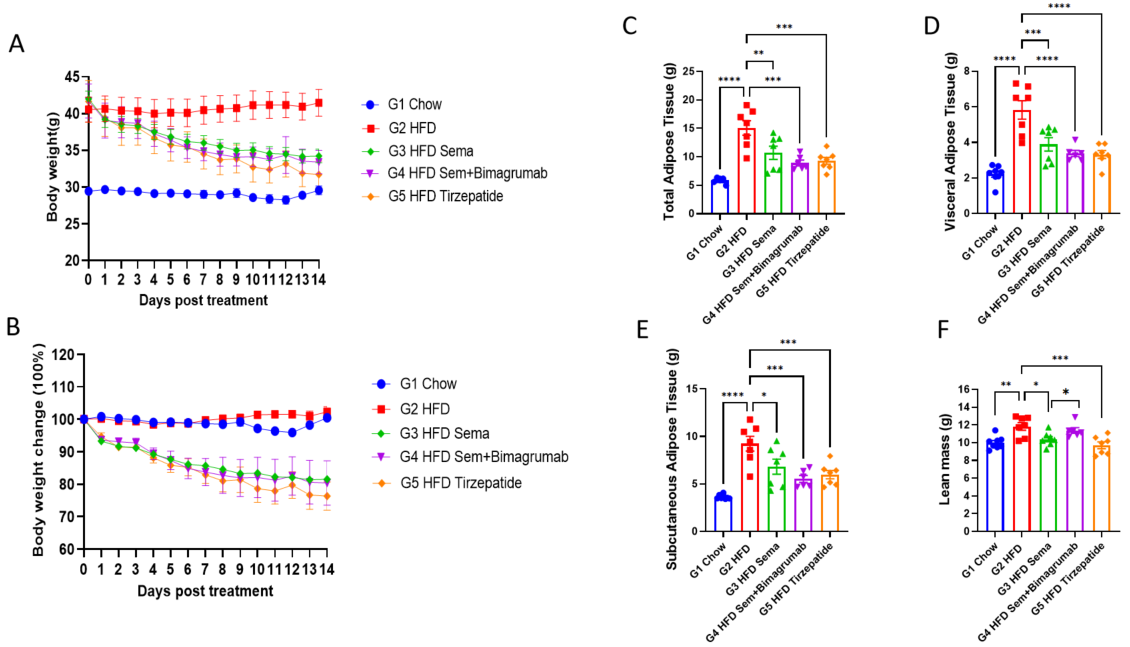
脂肪量と除脂肪量に対するGLP1RアゴニストおよびActRII抗体の有効性 A-B、治療後の体重変化。C-F、14日目における脂肪量および除脂肪量の変化をin vivoマイクロCTスキャンで分析。各グループN = 6-8匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
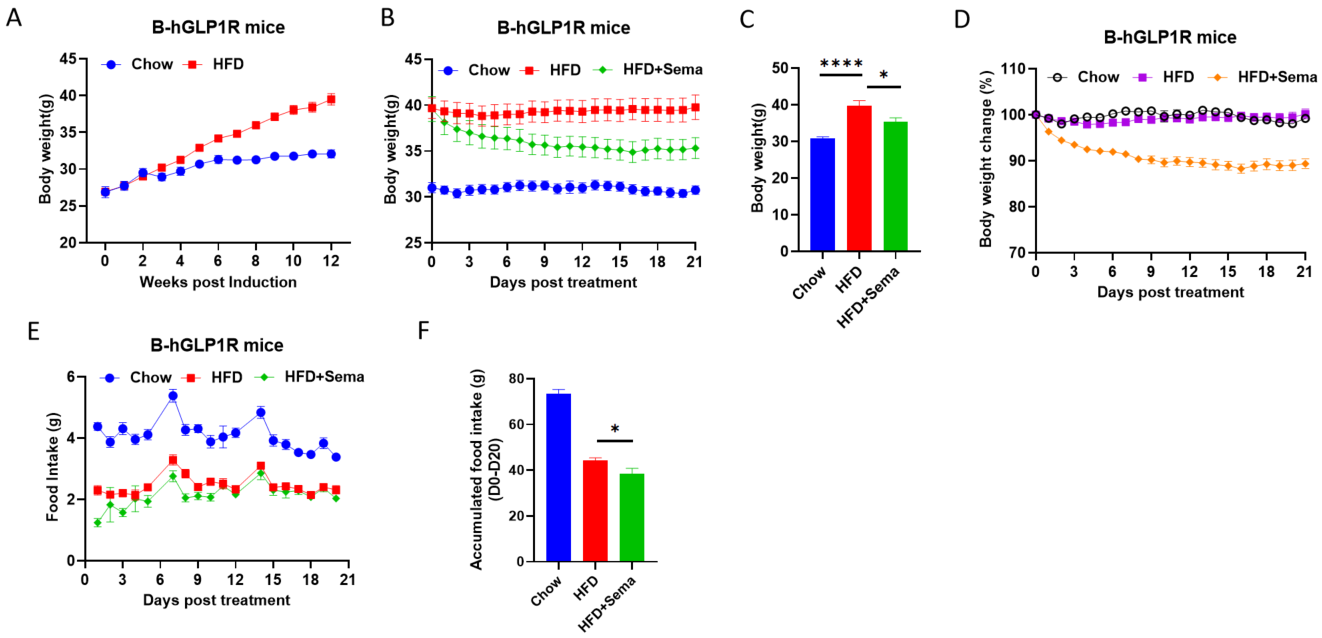
HFD誘発B-hGLP1RマウスにおけるSemaglutideの有効性 A、HFD誘導後の体重変化。B-D、Semaglutide治療後の体重変化。E-F、Semaglutideの食物摂取への影響。データは平均±標準誤差(SEM)として示されています。各グループN = 8-10匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
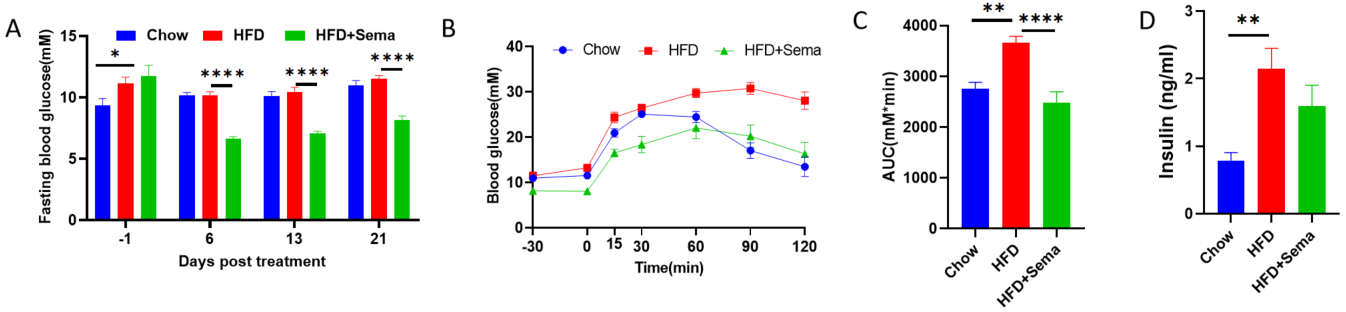
高脂肪食誘導マウスモデルにおけるSemaglutideの有効性 A、Semaglutide治療後の血糖の変化。B、治療後のグルコース耐性能力。C、Bの下の曲線面積。D、血漿インスリンレベル。データは平均値 ± 標準誤差(SEM)で表示されています。各群8〜10匹のマウス。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
レプチンは脂肪細胞によって分泌されるペプチドホルモンで、主に白色脂肪組織で発現します。さらに、レプチンは心筋、骨格筋、胎盤、肺、乳腺上皮、および胃粘膜にも発現しています。機能的には、レプチンは食欲を抑制し、エネルギー消費を増加させ、脂肪合成を抑制してその分解を促進します。インスリンはレプチンの分泌を促進し、レプチンはインスリンの合成と分泌に対してネガティブフィードバック調節を行います。
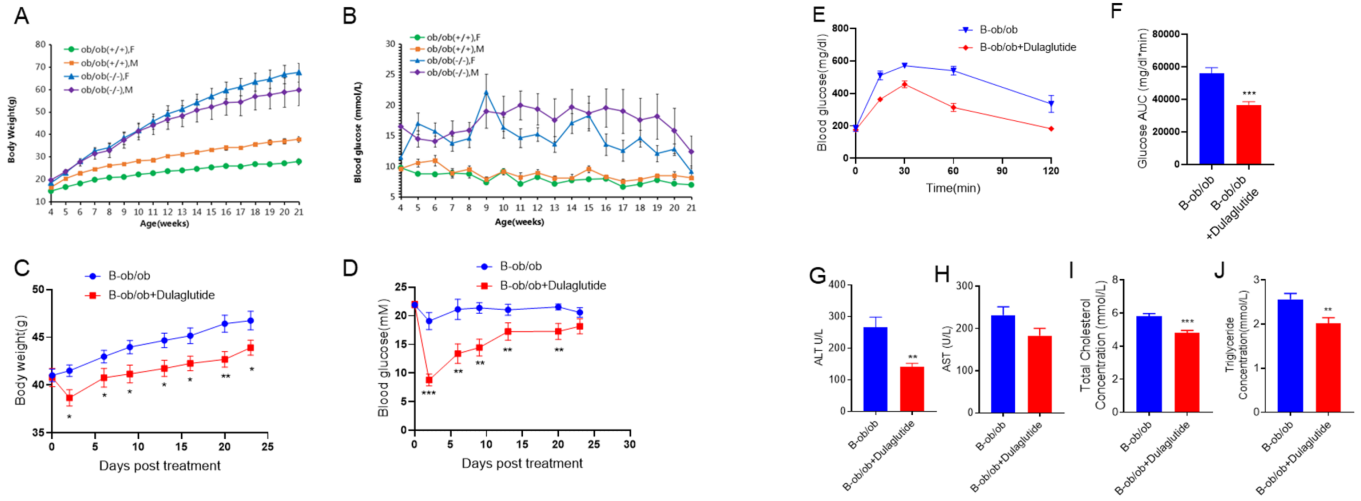
自然発性糖尿病マウスモデル A-B、4〜21週齢のB-ob/obマウスの体重および血糖の変化。C-F、9週齢のB-ob/obマウスをグループ分けした後、1mg/kgのDulaglutide(in house)を週2回、4週間投与しました。所定の時間に体重と血糖を記録しました。最後の投与の翌日にグルコース耐性試験を実施しました(各群8匹のマウス)。G-J、生化学的血液検査により、DulaglutideがB-ob/obマウスに与える効果が示されました。データは平均値 ± 標準誤差(SEM)で表示されています。**p<0.01、***p<0.001。(各群8匹のマウス)。
ストレプトゾトシン(STZ)は膵臓のβ細胞を破壊する抗生物質で、1型糖尿病(T1DM)のモデルを作るために広く使用されています。STZはアジト基を含む化合物で、膵臓のβ細胞を特異的に破壊し、一酸化窒素(NO)の合成を誘導することで、β細胞の酸化的侵入を増加させます。一般的に、低用量のSTZを複数回投与することで実験動物に1型糖尿病を誘発できます。そのメカニズムは、低用量のSTZ投与後、少量の膵臓細胞が破壊され、壊死した膵臓細胞がマクロファージによって抗原として感作されます。そして、Th1刺激因子(IL-12)を生成し、IL-2およびIFN-γの分泌を誘導することで膵臓局所で炎症細胞が浸潤し、IL-1β、TNF-α、IFN-γ、および酸素フリーラジカルなどの細胞因子を放出して、少数の細胞を壊死させます。壊死した細胞は、自らを抗原として使用し、APC細胞によって処理された後、細胞因子を放出し、細胞損傷効果を増強し、最終的に1型糖尿病に至ります。
| Included tests | Optional tests |
| Body weight | Insulin tolerance test |
| Blood glucose | Blood glucose |
| Glucose tolerance test | Food intake |
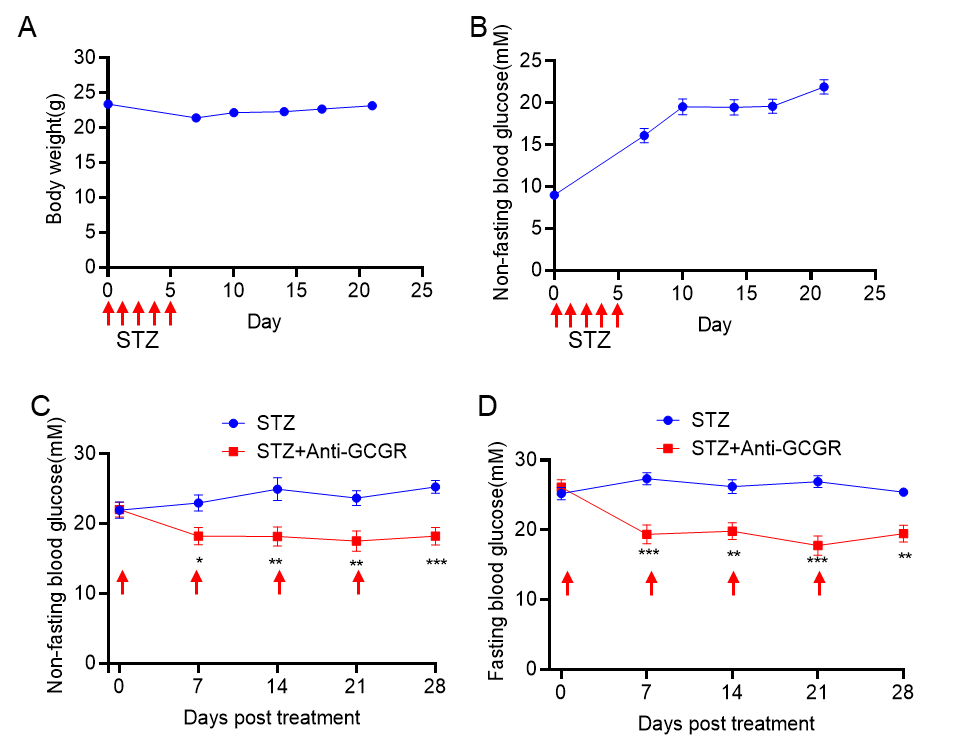
STZ誘導B-hGCGRマウスにおけるGCGR抗体の低血糖効果 A-B、STZ(50mg/kg)誘導後の6週齢B-hGCGRマウスの体重および血糖の変化(各群8匹のマウス)。C-D、STZ誘導後3週間でGCGR抗体(10mg/kg、in house)を毎週1回投与。非空腹血糖(C)および空腹血糖(D)を測定。データは平均値 ± 標準誤差(SEM)で表示されています。*p<0.05、**p<0.01、***p<0.001。