このページで
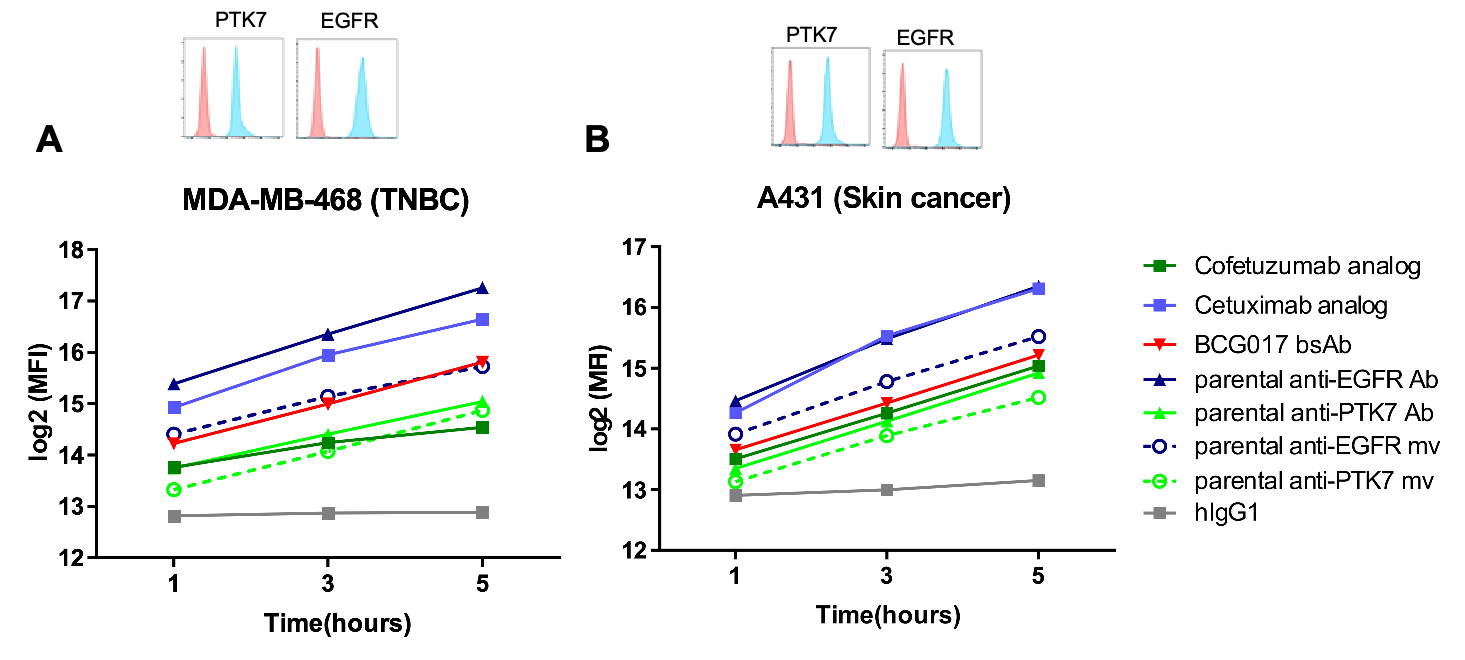
PTK7×EGFR抗体は、PTK7抗体と比較して、MDA-MB-468(A)およびA431(B)細胞系で内因性活性が増加しました。単一価(mv)抗EGFRの内因性は二価型に比べて顕著に減少しており、PTK7×EGFR二重特異的抗体が、EGFRアームに対する腫瘍選択性を持ちながら、PTK7アームの内因性を促進できることを示唆しています。
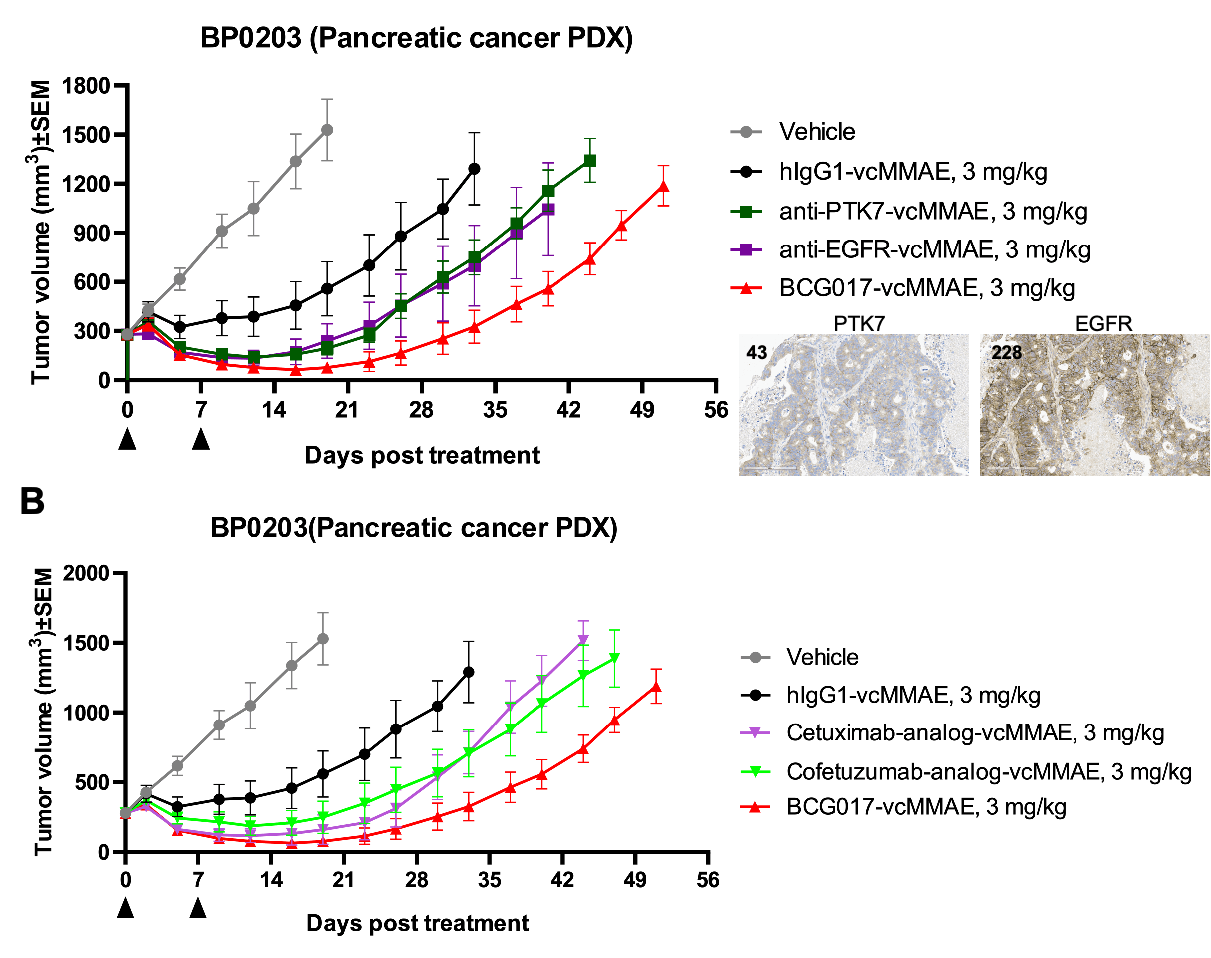
BCG017-vcMMAEは、PTK7低発現の膵臓PDXモデルで、親抗体ADC(A)および基準ADC(B)と比較して増強された抗腫瘍効果を示しました。
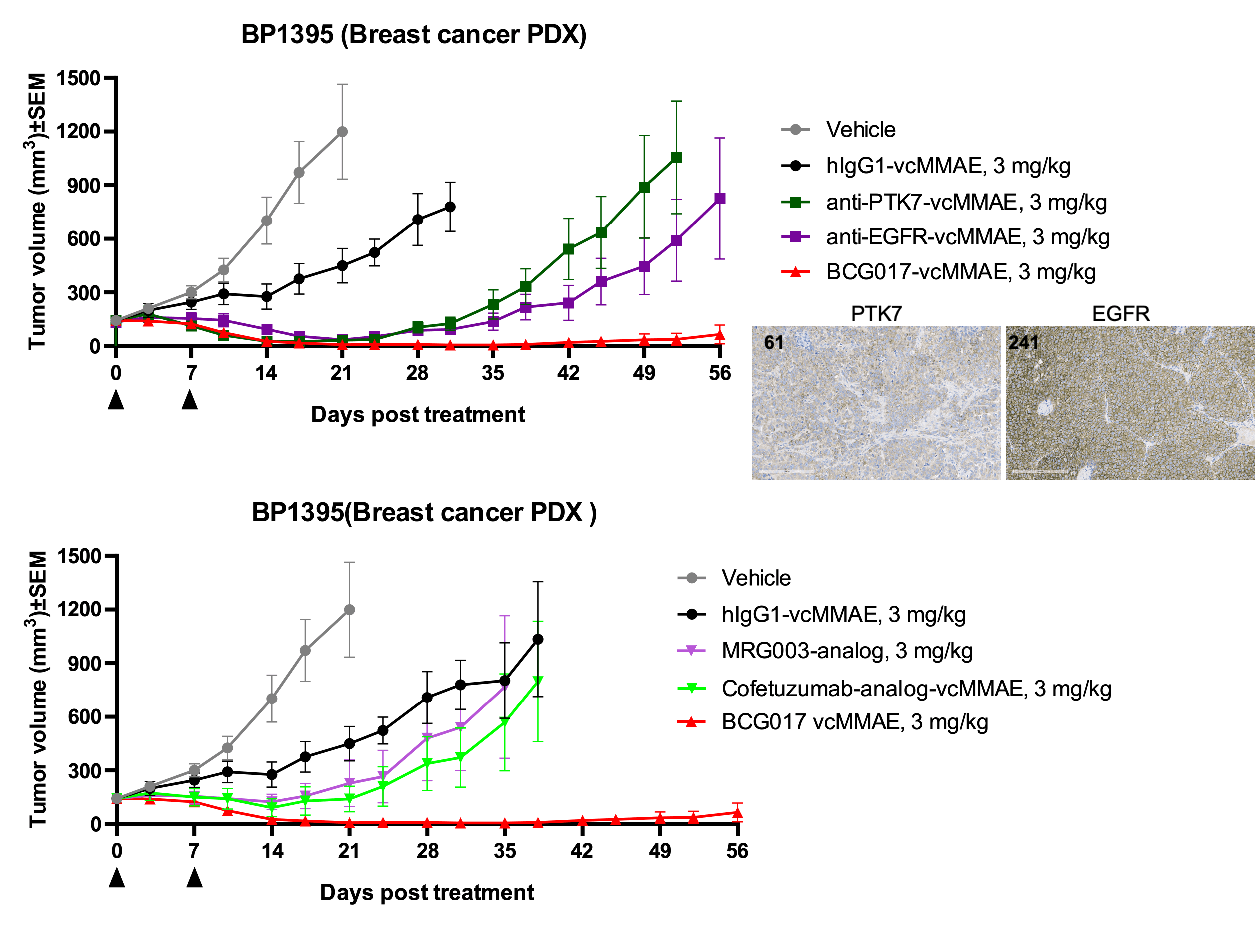
PTK7低発現の乳癌PDXモデルにおいて、BCG017-vcMMAEは、親抗体-ADCと比較して強力な効果を示し、BP0203データ(A)と一致し、基準ADC(B)を上回りました。MRG003は、MMAEを負荷とした臨床段階のEGFRターゲットADCです。
EGFRはさまざまな癌治療で広く利用されているターゲットです。しかし、EGFRをターゲットにした治療は、薬剤耐性やターゲット外毒性という課題に直面しています。EGFRをターゲットにしたADCは、結合されたペイロードの強力な殺傷効果により、薬剤耐性を克服するための有望な新しい治療戦略を示しています。さらに、EGFRと他の腫瘍関連抗原をターゲットにした二重特異性ADC(bsADC)の開発が、1+1形式で腫瘍選択性を向上させ、ターゲット外毒性を制限する可能性があると考えました。PTK7は腫瘍起始細胞で発現し、EGFRと同じ受容体チロシンキナーゼファミリーに属し、肺癌、頭頸部癌、食道癌、大腸癌などの多くの固形腫瘍でEGFRと共発現しています。
ここでは、当社の独自のRenLiteマウスプラットフォームと「knobs-into-holes」技術を使用して、完全ヒト抗ヒトPTK7×EGFR二重特異性抗体(bsAb)を開発し、これがin vitroで高い結合力と内部化を示しました。単一価EGFR抗体は予想通り内部化を減少させました。
RenLiteとADCプラットフォームについてさらに学ぶ。