あなたもお好きかもしれません
小分子药物的临床转化,往往止步于药效不佳、毒性超标或组织分布异常等难题,而这些问题的“源头”之一,正是长期被忽视的关键因素——外排转运体(efflux transporters)。作为细胞膜上的主动转运系统,它们以耗能方式将药物分子泵出细胞,直接主导药物的吸收、分布、代谢和排泄(ADME)过程,是决定药物能否进入靶点、停留多久、发挥多强作用的重要因素[1]。
在人体多种屏障组织中(如小肠、肝脏、肾脏、血脑屏障、胎盘等),外排转运体广泛分布,其对外来物质具有天然的“防御性”。这既是机体的保护机制,也成为药物研发过程中的障碍之一。尤其是ATP 结合盒(ATP-binding cassette,ABC)转运蛋白家族中的多药耐药蛋白1(P-糖蛋白,P-glycoprotein,P-gp,编码基因为 ABCB1)与乳腺癌耐药蛋白(Breast Cancer Resistance Protein,BCRP,编码基因为 ABCG2),它们能够识别多种结构各异的化合物,将其排出细胞外,是临床中多药耐药(MDR)现象的主要诱因。
在抗肿瘤、抗病毒、中枢神经系统疾病等领域中,P-gp与BCRP的高表达常常导致药物疗效下降、血药浓度偏低甚至完全失效。更为关键的是,这些转运体之间可能存在协同作用或功能互补,使得单一转运体的抑制往往无法完全揭示其在药代过程中的真实影响[2]。
正因如此,欧美及中国等药品监管机构(如FDA、EMA、NMPA)明确要求新药研发中必须系统评估候选药物是否为P-gp/BCRP底物或抑制剂,以预测潜在的药物-药物相互作用(DDI)风险,为临床使用提供安全保障[3]。
外排转运体的基本功能
BCRP(编码基因为ABCG2)和Mdr1(P-gp,编码基因为ABCB1)均属于ATP结合盒转运蛋白(ABC转运蛋白)家族,广泛分布于人体小肠、肝脏、肾脏、血脑屏障、胎盘、前列腺及子宫等关键药理路径和组织部位,发挥着减少药物在相关结构中累积的重要作用。药物分子可通过被动扩散或自由转运进入细胞,随后BCRP和P-gp识别并结合这些药物底物,依靠ATP水解提供能量,发生构象变化,将药物主动输送出细胞,从而调控药物的体内吸收、分布和排泄[4]。这一系列过程有力地降低了药物在细胞内的浓度水平,影响药效,并可能导致耐药。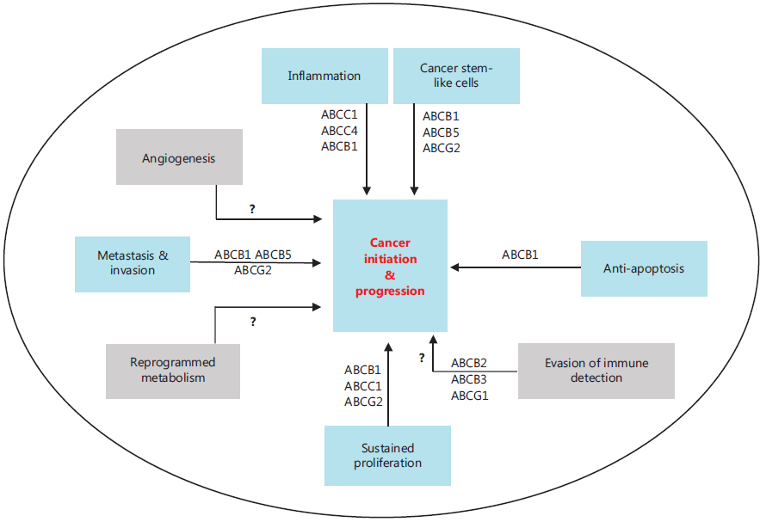
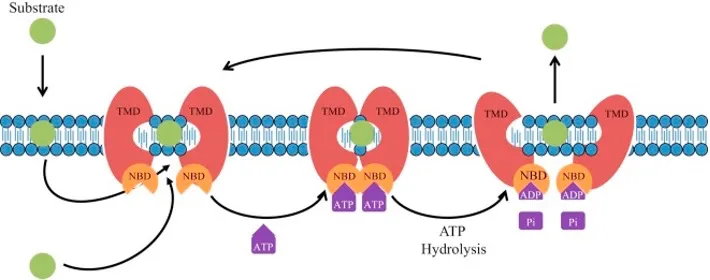
图1. ABC超家族成员及参与的相关信号通路[5]
为了克服传统体外模型在转运体功能评估中存在的准确性和生理相关性不足等局限,百奥赛图自主开发了针对上述靶点(BCRP,Mdr1)的基因敲除小鼠模型,能够更真实地模拟体内药物的分布、代谢及耐药机制,为药代动力学(PK)分析及脑部药效研究提供有力的实验支持。具体应用包括:
B-Bcrp KO mice验证数据
柳氮磺吡啶(Sulfasalazine)血浆浓度的测定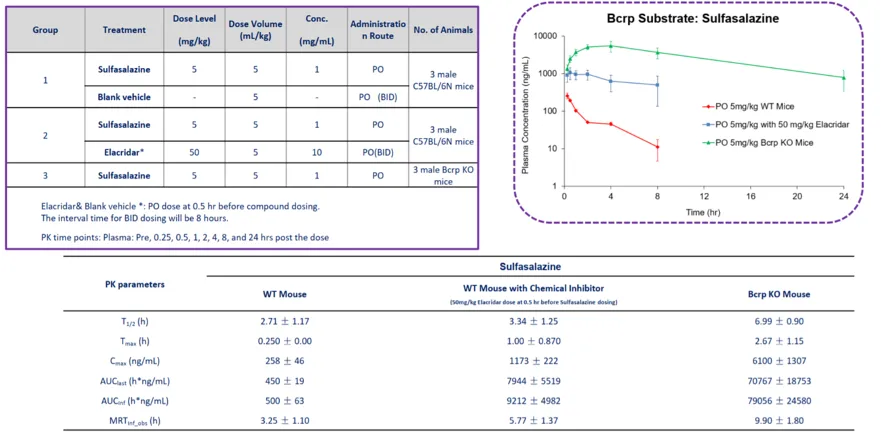
B-Bcrp KO小鼠与 C57BL/6N 小鼠的柳氮磺吡啶药代动力学。
雄性 C57BL/6N 小鼠单次口服给予柳氮磺吡啶(5 mg/kg,PO),并配合空白载体(vehicle 组)或 Elacridar(50 mg/kg,PO,每日两次,间隔 8 小时;首次给药时间为柳氮磺吡啶前 0.5 小时)。B-Bcrp 基因敲除小鼠仅口服柳氮磺吡啶。于给药前及给药后0.25、0.5、1、2、4、8 和 24 小时采集血浆样本(每组 n=3)。结果显示,C57BL/6N + Elacridar 组和 B-Bcrp 基因敲除组的柳氮磺吡啶血浆浓度均高于 C57BL/6N + 空白载体组。
注:本实验由康龙化成使用 B-Bcrp KO小鼠完成。
B-Mdr1 KO mice验证数据
地高辛(Digoxin)血浆浓度的测定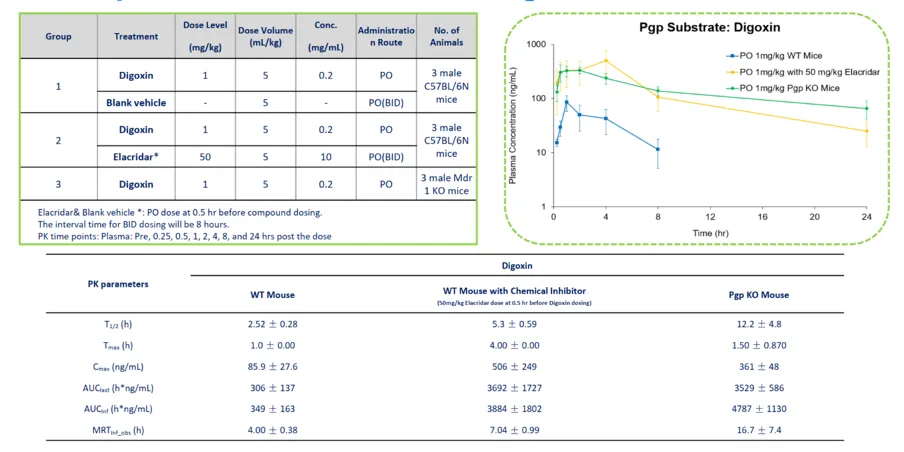
B-Mdr1 KO小鼠与 C57BL/6N 小鼠的地高辛药代动力学。
雄性 C57BL/6N 小鼠单次口服给予地高辛(1 mg/kg,PO),并配合空白载体(vehicle 组)或 Elacridar(50 mg/kg,PO,每日两次,间隔 8 小时;首次给药时间为地高辛前 0.5 小时)。B-Mdr1 基因敲除小鼠仅口服地高辛。于给药前及给药后 0.25、0.5、1、2、4、8 和 24 小时采集血浆样本(每组 n=3)。结果显示,C57BL/6N + Elacridar 组和 B-Mdr1 基因敲除组的地高辛血浆浓度均高于 C57BL/6N + 空白载体组。
注:本实验由康龙化成使用 B-Mdr1 KO小鼠完成。
B-Mdr1/Bcrp KO mice验证数据
巴瑞替尼(Baricitinib)血浆浓度的测定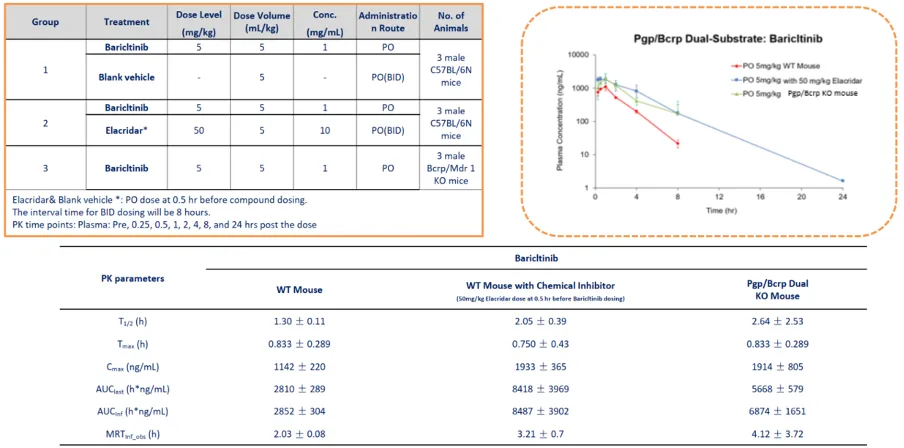
B-Mdr1/Bcrp KO小鼠与 C57BL/6N 小鼠的巴瑞替尼药代动力学。
雄性 C57BL/6N 小鼠单次口服给予巴瑞替尼(5 mg/kg,PO),并配合空白载体(vehicle 组)或 Elacridar(50 mg/kg,PO,每日两次,间隔 8 小时;首次给药时间为巴瑞替尼前 0.5 小时)。B-Mdr1/Bcrp 双基因敲除小鼠仅口服巴瑞替尼。于给药前及给药后0.25、0.5、1、2、4、8 和 24 小时采集血浆样本(每组 n=3)。结果显示,C57BL/6N + Elacridar 组和 B-Mdr1/Bcrp 双基因敲除组的巴瑞替尼血浆浓度均高于 C57BL/6N + 空白载体组。
注:本实验由康龙化成使用B-Mdr1/Bcrp KO小鼠完成。
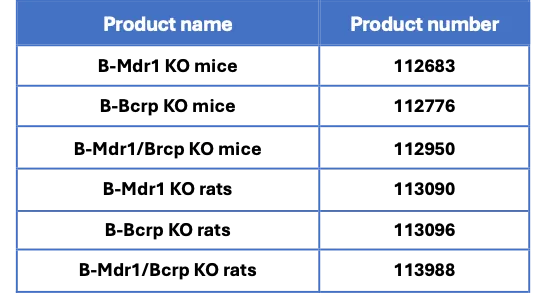
百奥赛图外排转运体相关产品列表
参考资料
[1] Agarwal S, Hartz AM, Elmquist WF, Bauer B. Breast cancer resistance protein and P-glycoprotein in brain cancer: two gatekeepers team up. Curr Pharm Des. 2011;17(26):2793-2802. doi:10.2174/138161211797440186
[2] Chen XY, Wu ZX, Wang JQ, et al. Multidrug resistance transporters P-gp and BCRP limit the efficacy of ATR inhibitor ceralasertib in cancer cells. Front Pharmacol. 2024;15:1400699. Published 2024 May 2. doi:10.3389/fphar.2024.1400699
[3] Bogaard L, Tsoi K, van de Steeg B, et al. A practical assessment protocol for clinically relevant P-glycoprotein-mediated drug-drug interactions. Front Pharmacol. 2024;15:1412692. Published 2024 Sep 30. doi:10.3389/fphar.2024.1412692
[4] Wang Y, Tu MJ, Yu AM. Efflux ABC transporters in drug disposition and their posttranscriptional gene regulation by microRNAs. Front Pharmacol. 2024;15:1423416. Published 2024 Jul 24. doi:10.3389/fphar.2024.1423416
[5] Chen, Zhaolin et al. “Mammalian drug efflux transporters of the ATP binding cassette (ABC) family in multidrug resistance: A review of the past decade.” Cancer letters vol. 370,1 (2016): 153-64. doi:10.1016/j.canlet.2015.10.010