あなたもお好きかもしれません
双特异性抗体(双抗,BsAbs)药物能同时靶向两个不同抗原表位,具有提高治疗特异性和效能的独特优势,尤其在肿瘤、免疫和自身免疫性疾病领域展现了巨大潜力。
2025年4月25日至30日,美国癌症研究协会(AACR)年会将在芝加哥召开,作为全球癌症研究领域备受关注的重要盛会,其已公布的常规摘要标题和正文显示,关于双抗和ADC项目的研究持续升温。
据不完全统计,今年有120多家中国药企亮相AACR会议,发布近300项新药研究成果,其中涵盖近40项双抗研究和80多项ADC研究。双抗/多抗已成为中国药企创新研发的核心方向之一,广泛布局于肿瘤免疫双抗、细胞因子融合双抗、T细胞重定向双抗和三抗、NK细胞重定向双抗、免疫检查点调节双抗等前沿领域。
众多研究机构和企业纷纷推出创新型双抗及双抗ADC,靶向EGFR、HER2、PD-1、VEGFA、TROP2、DLL3等关键肿瘤标志物,旨在提升疗效、降低毒性,并克服耐药性挑战。其中,不乏极具特色的技术平台和产品,例如岸迈生物的KLK2/CD3 TCE双抗,以及华辉安健和基石药业的PD-1/CTLA-4/VEGF三抗等。这些突破性研究进一步推动了抗体药物的创新发展。从靶向实体瘤的双抗ADC,到T细胞和NK细胞重定向双抗,再到免疫检查点双抗,双抗早已成为抗肿瘤药物开发的核心赛道之一。
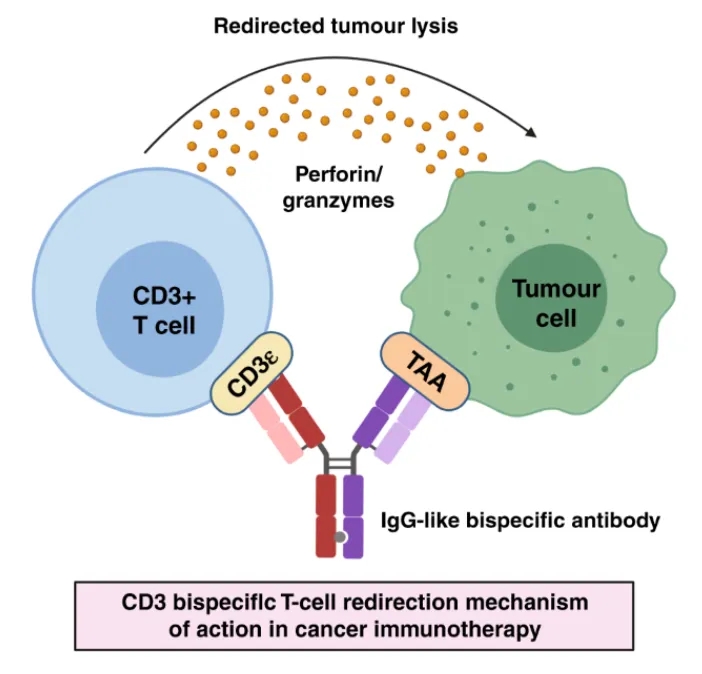
CD3+ 双特异性 T 细胞重定向在癌症中的作用机制[1]
然而,双抗药物的复杂结构带来了较高的研发难度,特别是在药效和安全性评估上需要依赖高效、可靠的模型。为应对这些挑战,百奥动物自主开发了专门针对双抗药物设计的评价模型和药效评估平台。该平台旨在为药物研发企业提供更加高效、精准的临床前研究支持,帮助企业在更短时间内推进药物开发,降低研发风险,推动双抗药物的创新和应用。
案例分享:基于人源化小鼠的CD3E双抗药效评估
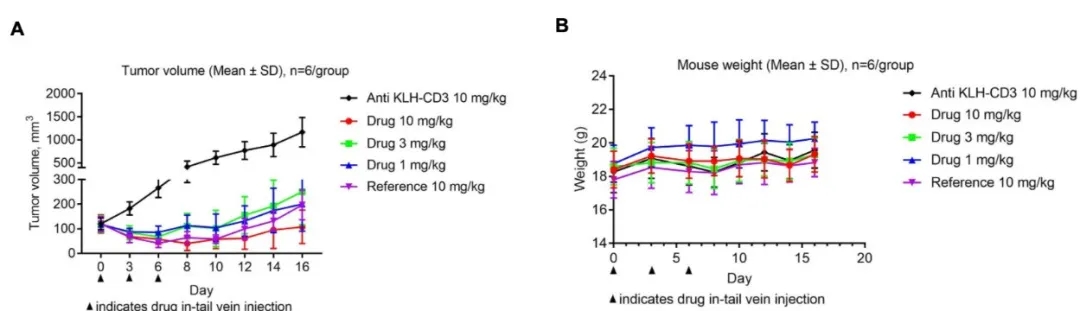
CD3E双抗在B-hCD3E小鼠中的抗肿瘤活性(合作数据)。(A) CD3E双抗在B-hCD3E小鼠中抑制肿瘤生长。(B) 治疗期间体重变化。如A图所示,客户提供的不同剂量的CD3E双抗在B-hCD3E小鼠中有效控制肿瘤生长,表明B-hCD3E小鼠可作为体内评估CD3E双抗的有力临床前模型。数值以均值 ± SEM 表示。
案例分享:基于免疫重建小鼠的CD3双抗药效评估
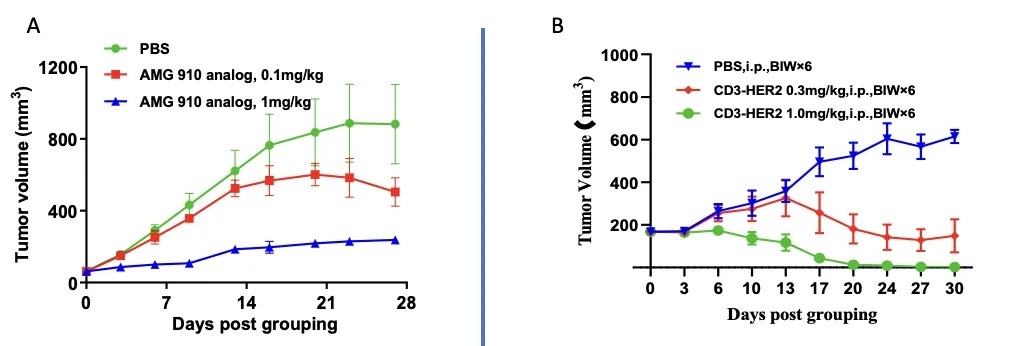
(A) 基于CD3的双特异性抗体研究的免疫系统重建模型。(B) 用于CD3×HER2双特异性抗体疗效研究的PBMC重建B-NDG小鼠模型。
案例分享:基于人源化小鼠的抗人CD16A双抗药效评估
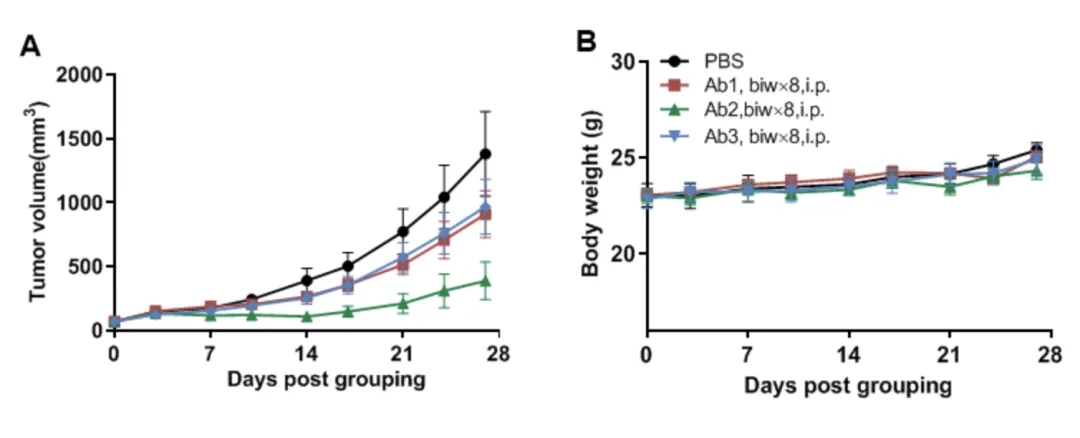
小鼠结肠癌MC38细胞皮下植入纯合B-hCD16A小鼠(雌性,13周龄,n=7)。当肿瘤体积达到约70 mm^3时,将小鼠分组,并使用抗人CD16A抗体治疗。如图A所示,抗人CD16A抗体可有效控制B-hCD16A小鼠的肿瘤生长,这表明B-hCD16A小鼠为体内评估抗人CD16A抗体提供了一个强大的临床前模型。数值表示为均值±SEM。
案例分享:基于免疫检查点人源化小鼠的双抗药效评估
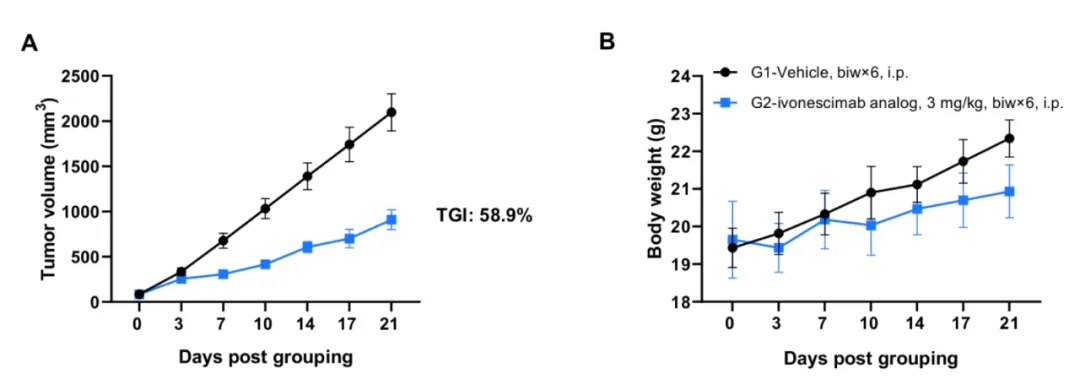
抗PD-1/VEGFA双特异性抗体(Ivonescimab类似物,内部制备)在B-hPD-1/hPD-L1/hVEGFA小鼠中的抗肿瘤活性。(A) 抗PD-1/VEGFA双特异性抗体在B-hPD-1/hPD-L1/hVEGFA小鼠中抑制了B-hVEGFA MC38肿瘤的生长。将小鼠结肠癌B-hVEGFA MC38细胞皮下接种至纯合B-hPD-1/hPD-L1/hVEGFA小鼠(雌性,8周龄,n=6)。当肿瘤体积达到约70-90 mm^3时,对小鼠进行分组,并按照图示方案进行抗PD-1/VEGFA双特异性抗体的腹腔注射。(B) 治疗期间小鼠体重变化情况。如图A所示,抗PD-1/VEGFA双特异性抗体在B-hPD-1/hPD-L1/hVEGFA小鼠中有效抑制肿瘤生长,表明该模型可作为体内评价抗PD-1/VEGFA双特异性抗体的强大临床前模型。数值以均值± SEM 表示。显著性分析采用双因素方差分析(Two-way ANOVA)检验。*P < 0.05,**P < 0.01,***P < 0.001。
案例分享:双抗体外功能检测
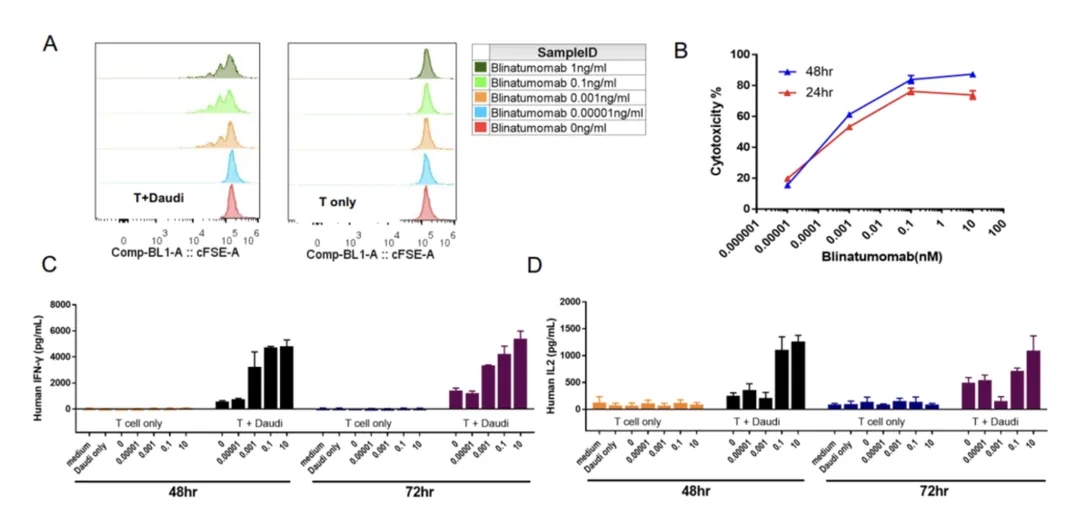
(A)T细胞与Daudi细胞共培养时,Blinatumomab以剂量依赖的方式促进T细胞的增殖。(B) Blinatumomab的细胞毒性以剂量依赖的方式增强(Daudi与T细胞的比例为10:1)。(C-D) Blinatumomab以剂量依赖的方式促进IFN-γ和IL-2的分泌。
百奥动物自主开发了一系列动物和细胞模型,覆盖多个领域,助力双抗药物临床前研究。
双抗研究相关模型列表(部分展示)
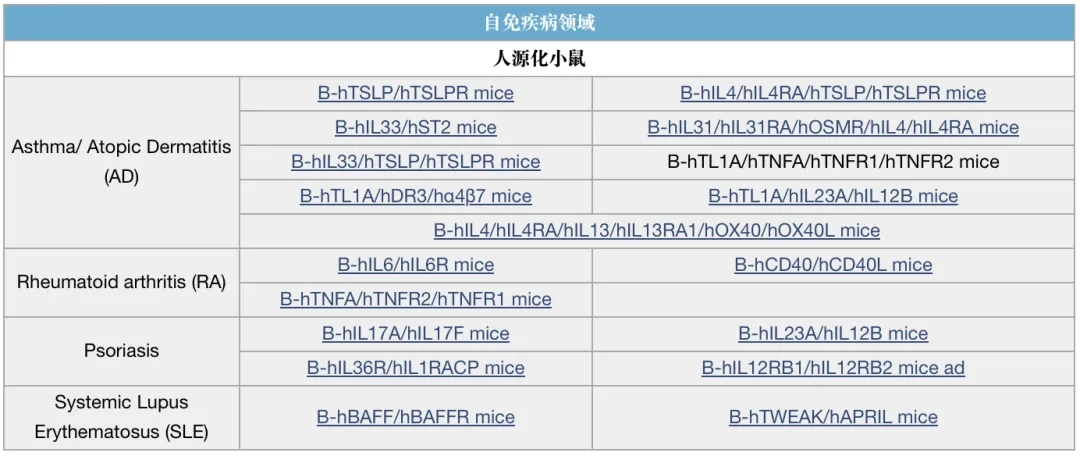
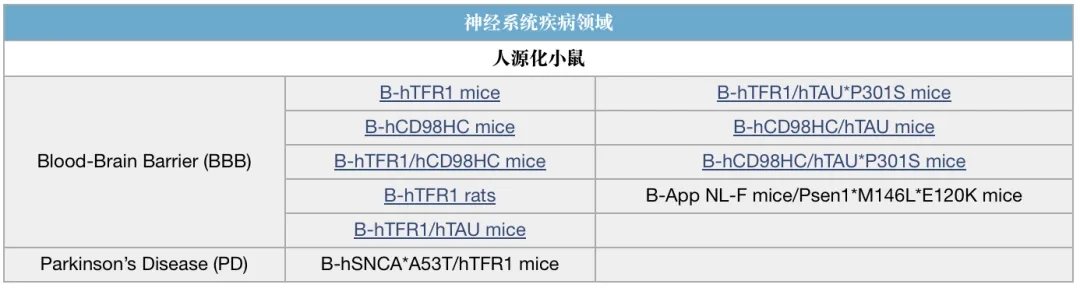
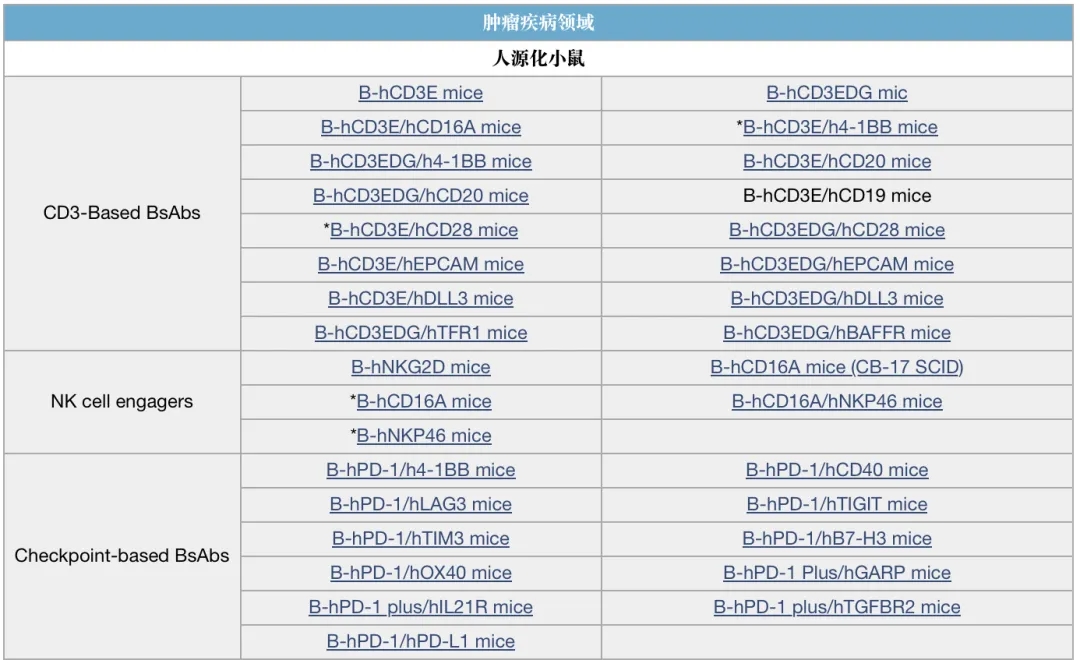
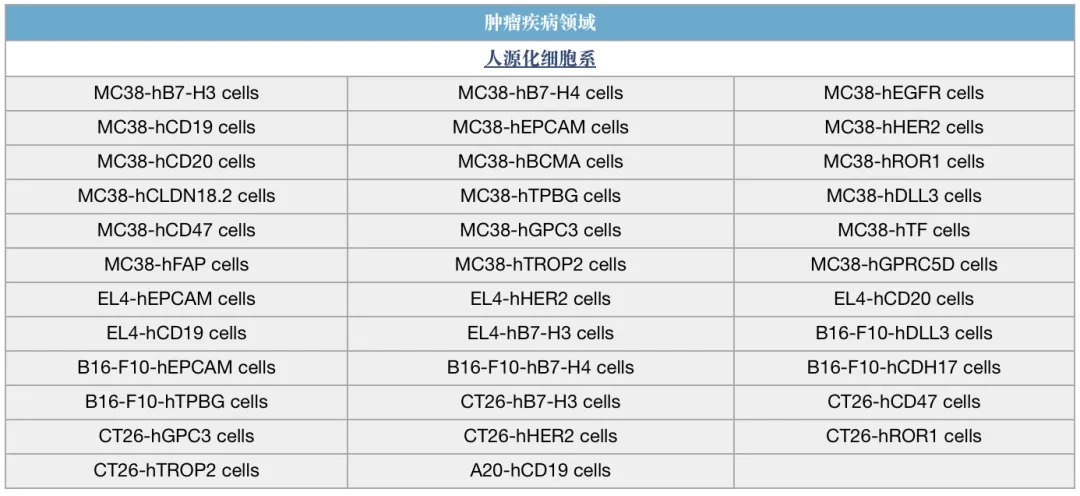
*表示有C57BL/6和BALB/c两个品系
参考文献
[1] Singh, Ajit et al. “Overcoming the challenges associated with CD3+ T-cell redirection in cancer.” British journal of cancer vol. 124,6 (2021): 1037-1048. doi:10.1038/s41416-020-01225-5